您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-09 10:45
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.泰它西普上美国肾病Ⅱ期临床。荣昌生物创新生物药泰它西普(RC18)用于治疗IgA肾病的美国Ⅱ期临床完成首例患者入组给药。RC18是一款双靶点新型融合蛋白,已于今年3月获批国内上市,用于治疗系统性红斑狼疮。目前RC18正在多项临床中评估治疗包括视神经脊髓炎谱系疾病、类风湿关节炎、IgA肾病等多种自身免疫性疾病的潜力。今年8月,泰它西普用于治疗IgA肾病的中国Ⅱ期临床已达到主要疗效终点。
2.他雷替尼上国际肺癌Ⅱ期临床。葆元医药新一代ROS1/NTRK抑制剂他雷替尼治疗ROS1融合阳性肺癌的国际Ⅱ期临床(TRUST-II)完成首例患者给药。该项研究计划入组119例ROS1融合基因的非小细胞肺癌患者,并根据ROS1抑制剂的治疗史分为四个队列,在每周期21天内每日使用 600 毫克的他雷替尼。主要研究临床终点是经确认的客观缓解率(cORR)。
3.复旦张江JAK1抑制剂报II期临床。复旦张江宣布其1类新药FZJ-003胶囊用于治疗中度至重度特应性皮炎(AD)的II期临床试验申请获得国家药监局受理。FZJ-003是一款口服JAK1选择性抑制剂,复旦张江目前正在I期临床试验中评估其治疗类风湿关节炎的有效性和安全性。目前,生物制剂在中重度AD治疗领域中占主导地位,国内尚无JAK1选择性抑制剂获批上市。
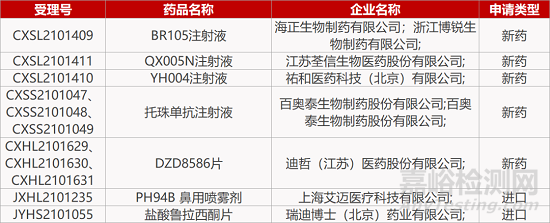
4.博锐生物SIRPα抗体报IND。博锐生物自主研发的治疗用生物制品1类新药BR105注射液的临床试验申请获CDE受理。BR105是一款SIRPα抗体药物,能识别SIRPα的常见基因型,并阻断SIRPα与其配体CD47的互相作用,解除“别吃我”信号,激活巨噬细胞发挥肿瘤吞噬作用,实现抗肿瘤免疫治疗。此前信达生物引进Alector的SIRPα抗体AL008(IBI397),已率先在国内报IND。
5.挚盟医药完成B轮融资。上海挚盟医药宣布完成3.5亿元B轮融资。本轮融资由尚珹投资(Advantech Capital)和达晨财智共同领投,紫曜基金、德屹资本、基石资本及达武创投跟投。三江资本担任本轮融资的首席财务顾问。此轮融资主要用于推进乙肝病毒核衣壳抑制剂ZM-H1505R在全球开展II期临床研究,以及明年初即将启动的拟用于治疗癫痫、疼痛、抑郁的KCNQ2/3钾离子通道开放剂和抗乙肝病毒免疫调节剂项目的临床研究。
国际药讯
医药热点
1.海南实现献血者用血费直免。海南省“三医联动一张网”项目的重要子系统--无偿献血者血费直免系统日前正式上线。该系统依托于海南省血液信息化大平台建设,使省内血站与用血医疗机构无偿献血者信息互联互通,实现“一个窗口受理、一次性告知、一站式服务”,无偿献血者及亲属省内就医时血费出院直接减免。
2.华人团队开发出“拔罐法”新冠疫苗接种。美国罗格斯大学的林灏团队受到拔罐疗法的启发,创造了一种将DNA分子转染到皮肤细胞中的疫苗接种新方法。这种方法是指直接注射纯化的DNA疫苗后,在注射部位施加吸力,使皮肤产生负压,导致皮肤产生张力并松弛,从而触发皮肤细胞对DNA分子的吸收。在动物实验中,与单独注射新冠DNA疫苗相比,这种拔罐法递送的疫苗所产生的免疫反应增强约100倍。研究成果发布在 Science Advances 期刊上。
3.金力就任复旦大学校长。教育部官网发布中共中央、国务院的任免决定,金力任复旦大学校长(副部长级),许宁生不再担任复旦大学校长职务。公开资料显示,金力,男,1963年出生于上海,浙江上虞人。中共党员,复旦大学常务副校长,复旦大学医学院党委副书记、院长,中国科学院院士,复旦“浩清”教授。
评审动态
1. CDE新药受理情况(11月08日)

来源:药研发


