您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-02 11:22
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
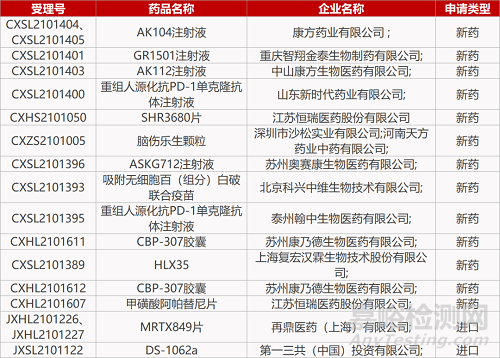
1.君实PD-1单抗BLA获优先审评。FDA受理君实生物PD-1特瑞普利单抗的生物制品许可申请(BLA),联合吉西他滨/顺铂一线治疗晚期复发或转移性鼻咽癌,以及单药二线及以上治疗复发或转移性鼻咽癌。FDA同时授予该BLA优先审评资格,PDUFA日期为2022年4月。在一项III期JUPITER-02研究中,特瑞普利单抗联合吉西他滨/顺铂一线治疗复发或转移性鼻咽癌患者可显著延长患者的无进展生存期。美国尚无肿瘤免疫疗法获批用于鼻咽癌的治疗。
2.艾弗沙治疗肺癌Ⅲ期临床成功。艾力斯医药第三代EGFR-TKI类药物艾弗沙(甲磺酸伏美替尼,AST2818)一线治疗EGFR敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)的Ⅲ期临床(FURLONG)达到主要终点指标。与一代EGFR-TKI相比,伏美替尼治疗组显示出具有显著统计学意义的无进展生存(PFS)获益。具体结果将在国际学术大会上公布。
3.德琪PD-L1/4-1BB双抗在美获批临床。德琪医药新型PD-L1/4-1BB双抗ATG-101获FDA批准,即将在美国开展一项I期临床,在晚期实体瘤和非霍奇金淋巴瘤患者中评估ATG-101治疗的安全性及耐受性。此次批准是继在澳大利亚获批并启动I期临床试验后,ATG-101在全球范围内获批的第二个临床试验,也是德琪医药在美国获批的首个临床试验申请。
4.重庆智翔IL-17A单抗报IND。重庆智翔金泰生物1类新药GR1501注射液的临床试验申请获CDE受理。GR1501为一款IL-17A单抗药物,能够有效抑制IL-17,从而起到炎症消除的作用,已在国内获批开展针对斑块状银屑病、银屑病关节炎、强直性脊柱炎的临床试验。全球范围内已有Siliq(Brodalumab)、TALTZ(Ixekizumab)和Cosentyx(Secukinumab)等同靶点药物获批上市。
5.奥赛康治疗视网膜疾病新药报IND。苏州奥赛康1类生物新药ASKG712注射液的临床试验申请获CDE受理,拟开发用于视网膜疾病的治疗。ASKG712为奥赛康自主研发的抗VEGF-A人源化单克隆抗体-Ang-2抑制肽融合蛋白,能够有效抑制VEGF信号通路减少新生血管的生成,还能阻断Ang-2信号来改善血管稳定性与视网膜炎症。与传统的VEGF单抗疗法相比,ASKG712有望减少眼部注射的给药频率,提高患者的依从性。
6.信达拟联合新合生物开展临床研究。信达生物PD-1信迪利单抗拟联合新合生物个性化mRNA新抗原疫苗NEO_PLIN2101开展临床试验,评估联合治疗实体瘤患者的安全性、药代动力学、药效学和初步疗效。NEO_PLIN2101可根据每例患者肿瘤基因突变点进行个性化定制,通过高通量样本测序及AI算法,从肿瘤特异性突变细胞中筛选出优质新抗原片段,在体外合成对应编码的mRNA新抗原疫苗,回输到患者体内激活T细胞,以杀死肿瘤细胞。
国际药讯
1.替洛利生治疗嗜睡获欧盟批准。欧洲药品管理局批准法国Bioprojet公司H3受体拮抗剂/反向激动剂Ozawade(pitolisant,替洛利生)新适应症,用于成人患者治疗与阻塞性睡眠呼吸暂停(OSA)相关的白天过度嗜睡(EDS)。Ozawade通过增强组胺能神经元活性增加大脑中促进觉醒的神经递质组胺的合成和释放,提高患者的清醒度和警觉性。它此前已获欧盟和美国批准上市,以商品名Wakix®销售,用于治疗伴或不伴猝倒的发作性睡病(narcolepsy)。
2.帕金森病皮下输注疗法Ⅲ期临床积极。艾伯维持续皮下输注给药的帕金森病疗法ABBV-951(foslevodopa/foscarbidopa)在关键Ⅲ期临床中达到主要终点。与口服左旋多巴/卡比多巴相比,ABBV-951不间断皮下输注治疗组患者第12周时“Good On”时间增加2.72小时(vs0.97小时,p=0.0083);“Off”时间降低了2.75小时(vs0.96小时,p=0.0054);两组严重AE发生率分别为8%和6%。完整结果将在医学会议上公布。
3.GLP-1类似物获FDA孤儿药资格。FDA授予ImmunoForge公司候选药物PF1801孤儿药资格,用于治疗多发性肌炎(PM)。PF1801是重组胰高血糖素样肽-1(GLP-1)类似物,可结合并激动GLP-1受体。除PM外,其在研疾病领域还涵盖杜氏肌营养不良(DMD)、老年肌肉衰减症和包涵体肌炎。今年2月,FDA已授予PF1801用于治疗DMD的孤儿药资格。
4.新型乳腺癌疫苗步入临床。美国克利夫兰诊所(Cleveland Clinic)宣布启动抗α-乳白蛋白免疫疗法Ⅰ期临床,在18至24例早期三阴性乳腺癌患者(TNBC)中评估用于预防癌症复发的效果。临床前研究表明,激活针对α-乳白蛋白的免疫反应在小鼠模型中可安全有效地预防乳腺癌;单次接种疫苗不但可以防止小鼠模型中乳腺癌的发生,也抑制了已存在的乳腺癌的生长。相关论文发表在Nature Medicine杂志上。
5.AD干细胞疗法临床前数据积极。GABAeron公司基于诱导多能干细胞(iPSC)的阿尔茨海默病细胞疗法临床前研究数据积极。研究人员将人iPSC分化生成的GABA能中间神经元祖细胞移植到携带APOE4基因的小鼠(10个月大)的海马体中,7个月后,超过一半的存活细胞已迁移出局部区域,填充在海马体的不同亚区,成功与海马体的其他现有神经元建立连接;而且观察到小鼠海马体的活动改善达到了健康小鼠水平。
6.吉利德与默沙东达成临床试验合作。吉利德TROP2-ADC新药Trodelvy拟联合默沙东重磅PD-1抑制剂Keytruda开展一项全球性Ⅲ期临床,评估Trodelvy与Keytruda联用,与Keytruda和化疗联用(目前的标准疗法)相比,一线治疗局部晚期或转移性三阴性乳腺癌(TNBC)的安全性与有效性。Trodelvy是一款“first-in-class”靶向TROP2的抗体偶联药物,已获FDA完全批准上市,用于二线治疗TNBC患者。
医药热点
1.国家加快推进康复医疗工作发展。为切实推动各地按照《关于印发加快推进康复医疗工作发展意见的通知》落实相关任务,国家卫健委日前印发了《关于开展康复医疗服务试点工作的通知》(国卫办医函〔2021〕536号),确定在北京、天津等15个省份率先开展康复医疗服务试点工作。重点在康复医疗服务体系、多元化服务模式、专业队伍建设以及价格支付等支持政策方面积极探索创新。试点期限一年,2022年1月—12月。
2.赵军宁任国家药监局副局长。10月29日,中国政府网发布《国务院任免国家工作人员》。其中,任命赵军宁为国家药监局副局长。赵军宁,男,江苏江宁人,医学博士、药学博士后。曾任四川省中医药科学院院长 、四川省中医药转化医学中心主任 、国家中医药管理局中药质量生物评价重点研究室主任 、四川省科技厅道地药材系统开发中心主任 、四川省发改委道地药材形成原理与品质评价中心主任 。
3.新冠康复者恢复期血浆临床治疗方案发布。国家卫健委日前发布了《新冠肺炎康复者恢复期血浆临床治疗方案(试行第三版)》。在临床应用指南部分,新版治疗方案进一步细化恢复期血浆临床应用适应症,明确临床应用遵循原则,恢复期血浆主要用于病情进展较快、具有高危因素的普通型以及重症、危重症新冠肺炎患者;完善输注原则,要求优先选择ABO和RhD同型血浆输注。
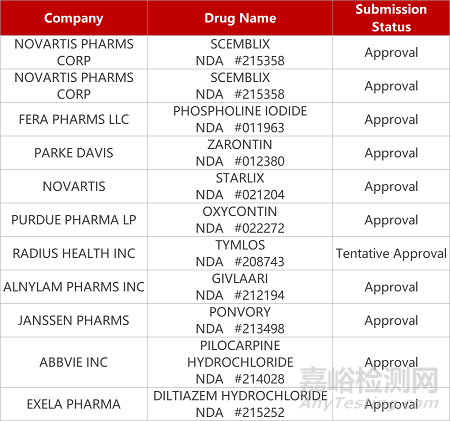
评审动态

来源:药研发


