您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-13 11:39
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
赛生药业新型抗生素国内报NDA。赛生药业与Theravance公司联合开发的注射用盐酸替拉凡星(telavancin)在国内申报上市。该新药是一款每日1次的脂糖肽类抗生素,是万古霉素的半合成衍生物,已在美国获批用于治疗革兰阳性菌包括MRSA引起的复杂性皮肤软组织感染(cSSTI)以及由金黄色葡萄球菌易感分离株导致的医院获得性和呼吸机相关细菌性肺炎(HABP/VABP),商品名为:Vibativ。
国内药讯
1.亿一生物长效升白药申报欧盟上市。欧盟EMA受理亿帆医药旗下亿一生物自主研发的贝格司亭F-627的上市许可申请(MAA),用于预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症。F-627是一款重组人粒细胞集落刺激因子-Fc融合蛋白,FDA已于今年5月受理F-627的BLA申请。在中国,亿帆医药计划今年年底或明年年初递交上市申请,预计将于2022年取得批准。
2.赛诺菲长效降糖复方中国Ⅲ期临床积极。赛诺菲甘精胰岛素利司那肽注射液(iGlarLixi)在EASD2021年会上公布其中国Ⅲ期临床LixiLan-L治疗糖尿病的研究数据。相较基础胰岛素治疗组,iGlarLixi治疗组患者在降低HbA1c方面达到主要疗效终点,两个治疗组30周时HbA1c达标(HbA1c<7%)的患者比例分别为63%和30%;此外,iGlarLixi组在餐后血糖控制、体重控制以及低血糖发生率等次要终点方面均优于基础胰岛素组。iGlarLixi的新药上市申请已获NMPA受理。
3.瑞石外用JAK1抑制剂Ⅱ期临床积极。瑞石生物JAK1抑制剂SHR0302乳膏在治疗轻中度特应性皮炎的Ⅱ期临床中获积极结果。与安慰剂组相比,三种剂量SHR0302均达到关键性主要和次要终点,治疗第8周时显著改善患者的湿疹面积和严重程度指数(EASI)评分,并迅速降低瘙痒程度;而且SHR0302耐受性良好,治疗相关不良事件与安慰剂组相当。SHR0302目前也在多个后期临床中用于治疗白癜风、溃疡性肠炎、克罗恩病和斑秃等免疫炎症疾病。
4.欧康维视干眼症新药获批临床。欧康维视OT202滴眼液临床试验申请获国家药监局默示许可,拟开发用于治疗干眼症。OT202是欧康维视自主研发的一种酪氨酸激酶抑制剂,通过抑制Syk激酶的活性达到抗炎作用,在豚鼠免疫型干眼症模型及小鼠东莨菪硷干眼症模型中均显示出显著的治疗及抗炎作用。毒理学研究亦指出其在动物体内具有良好的耐受性。这是OT202首次获批临床。
5.百奥赛图与TRACON合作开发CTLA-4单抗。10月11日,百奥赛图子公司祐和医药宣布与TRACON签署战略合作协议,TRACON将负责YH001在以美国为主的北美地区针对软组织肉瘤及多项双方约定的适应症的临床开发及商业化,祐和医药将保留北美地区其他适应症的开发及商业化权益。YH001是百奥赛图自主研发的具有best-in-class潜力的CTLA-4单抗,具有增强的ADCC和CDC活性,已获FDA批准开展II期临床研究。
6.豪森联合OliX开发siRNA疗法。豪森与OliX制药将利用OliX公司GalNAc-asiRNA技术平台联合开发siRNA疗法,用于治疗心血管、代谢疾病及其他肝脏相关疾病。根据协议,OliX公司将为豪森所选的特定靶点开发候选siRNA药物;豪森将拥有这些疗法在中国(包括香港、澳门及台湾)的独家商业权益;OliX将拥有中国以外其他地区的权益,并获得650万美元的首付款及最高超过4.5亿美元基于重要里程碑的特许权许可分成。
国际药讯
1.泪小管内插物获批新适应症。FDA批准Ocular Therapeutix地塞米松缓释泪点塞Dextenza扩大标签,增加治疗过敏性结膜炎相关眼部瘙痒的新适应症。Dextenza是首款获FDA批准的泪小管内插物,由可吸收材料制成,而且不含防腐剂,单次插入可持续释放地塞米松长达30天。此前,Dextenza已获FDA批准用于治疗眼科手术后的眼部疼痛,以及眼科手术后的眼部炎症。
2.默沙东抗新冠口服药物报EUA。默沙东和Ridgeback Biotherapeutics公司宣布,默沙东已向FDA递交口服抗新冠病毒疗法molnupiravir的紧急使用授权(EUA)申请。Molnupiravir是一款强力核糖核苷类似物,如果获批将成为全球首款用于新冠治疗的口服药,为抗击疫情增加一种全新的、易于使用的工具。目前,美国新冠累计确诊病例已超过4500万人,死亡病例超过73万人,他们绝大多数都是未接种者。
3.礼来JAK抑制剂治疗斑秃Ⅲ期临床积极。礼来与Incyte公司日前公布JAK抑制剂巴瑞替尼(baricitinib,Olumiant)治疗斑秃的两项关键性Ⅲ期临床详细结果。在BRAVE-AA1试验中,baricitinib治疗组16周时头皮毛发覆盖面积达80%以上的患者比例为18.5%(vs4.2%,p<0.001)。在BRAVE-AA2试验中,baricitinib治疗组24周时患者头皮毛发覆盖率超过80%的患者比例为28.2%(vs1.3%,p<0.001)。baricitinib安全性特征与此前发表的数据一致,没有发现新的安全性信号。
4.眼科基因疗法早期临床结果积极。4D Molecular公司开发的玻璃体内注射基因疗法4D-125,在治疗晚期X连锁视网膜色素变性(XLRP)的Ⅰ/Ⅱ期临床中获积极中期数据。4D-125在所有8例患者中均耐受良好,未观察到剂量限制性毒性或严重不良事件。与对照眼相比,治疗眼的感光细胞得以更好的保存,而且治疗眼平均视网膜敏感度获得改善,敏感度提高≥7 dB的位点数量比对照眼更多。
5.功能性治愈乙肝候选ASO疗法上临床。Aligos公司反义寡核苷酸(ASO)在研疗法ALG-020572完成Ⅰ期临床首例患者给药。ALG-020572通过与mRNA互补结合,干扰遗传信息从核酸向蛋白质的传递,从而降低慢性乙肝患者的HBsAg水平。该项临床将在健康志愿者中评估ALG-020572单次皮下给药的安全性、耐受性和药代动力学,并在慢性乙肝患者中评估多次皮下给药的安全性、药代动力学和抗病毒活性。
6.默沙东收购Acceleron公司。默沙东拟以总价值约合115亿美元收购Acceleron公司。Acceleron是一家罕见疾病药物研发公司,主要候选药物Sotatercept是一款旨在重新平衡TGF-β 超家族信号传导的在研逆重塑剂,目前正在Ⅲ期临床中用于治疗肺动脉高压(PAH),FDA已授予其「罕见病药物」和「突破性疗法」资格认定。此外,Acceleron还拥有一款已在美国等多国获批上市的、用于治疗罕见血液病的红细胞成熟剂REBLOZYL®(luspatercept-aamt)。
医药热点
1.张江成立AI新药研发联盟。10月12日,在张江生命科学国际创新峰会上,张江发布AI智药生态计划并揭牌AI新药研发联盟。AI新药研发联盟由20余家企业组建,旨在以关键项目为牵引、联合开展协同攻关,并共同打造AI智药“1+3”产业版图,争取到2025年,生态内集聚300家活跃机构、30个创新联合体、30个赋能平台,AI助力每年新增30个1类新药管线。
2.上海打造100个智慧养老院。上海市印发《上海市养老服务发展“十四五”规划》,提出推动养老服务领域数字化转型,提高养老服务品质。打造100个智慧养老院、1000个数字化社区养老服务场所,培育一批智慧养老应用示范基地、示范社区和示范品牌。大力推进“养老院+互联网医院”发展模式。支持发展采用“互联网+”服务模式的专业服务机构,为居家老年人提供远程照护服务。
3.台湾通报新冠疫苗接种后不良事件。根据台湾卫生部门发布的一份《COVID-19疫苗接种后不良事件通报》,自今年3月22日开始接种疫苗至10月6日期间,台湾接种疫苗后死亡人数达到849人。而截至6日,疫情以来,台湾因确诊新冠死亡的病例数为844人,这是接种疫苗后死亡人数首次超过确诊死亡人数。
4.CDE公开征求2项技术指导原则意见。10月11日,CDE官网公开征求2项技术指导原则意见,分别为《罕见疾病药物临床研发技术指导原则(征求意见稿)》和《长效粒细胞集落刺激因子预防化疗后感染临床试验设计技术指导原则(征求意见稿)》。征求意见时限均为自发布之日起1个月。
评审动态
申请临床:
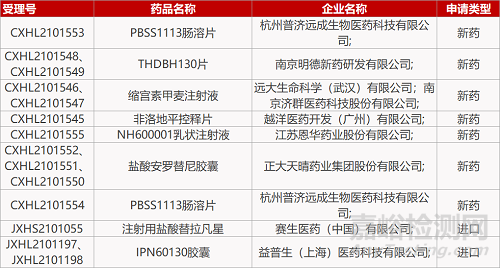
杭州普济远成生物的PBSS1113肠溶片(2个规格)、南京明德新药公司THDBH130片(2个规格)、远大生命科学/南京济群医药的缩宫素甲麦注射液(2个规格)、越洋医药的非洛地平控释片、江苏恩华药业的NH600001乳状注射液、正大天晴的盐酸安罗替尼胶囊(2个规格)、益普生的IPN60130胶囊(2个规格)。
申请生产:
赛生医药的注射用盐酸替拉凡星。

来源:药研发