您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-09-27 11:06
1、货架有效期研究到底做加速老化还是实时老化实验?
提到货架有效期,你最先想到的是什么?那当然是:做加速还是实时老化实验了。你看,肤浅了不是,货架有效期研究绝不是一个简单的实验问题,应在设计开发之初,从材料特性,成品性能,运输和包装,是否无菌提供等方面综合考虑,进行验证。比如产品预期运输场景,是否可能出现极端环境。
说回咱们肤浅的层面,产品注册时研究都做完了,甚至境外都上市了,说明书也有了,那到底能不能交加速老化实验结果呢?这就要看产品所采用的实验方法是否科学了,比如材料是否适用阿列纽斯反应速率函数。只要方法科学,就可接受。
2、首次申报提交了加速老化,变更时必须提交实时老化结果?
这是一个误区,如果产品适用加速老化实验,不会因为申报事项不同而对应不同的实验。在实际审评过程中,首次申报提交了加速实验,发补时可能要求提供实时方案,目的是为了确定实时与加速的结果一致。但是后续的实验是否进行,结果如何,审评往往就不知情了。
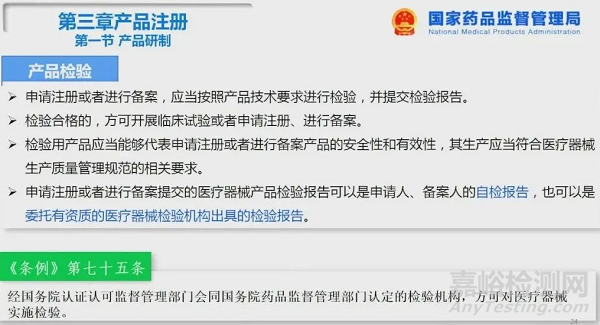
3、自检报告的执行解读
1、自检不是唯一的途径,只是一个方式,从来没有说过只能交自检报告。按照现在的方法去第三方检测不会对注册申报产生影响。
2、委托第三方检测机构就必须委托有资质的。有关资质的问题,《条例》第七十五条已明确了,经国务院认证认可监督管理部门会同国务院药品监督管理部门认定的检验机构,方可对医疗器械实施检验。
3、自检是现阶段是重点检查方向。注册管理办法中已提到:提交自检报告的,应当对申请人、备案人或者受托机构研制过程中的检验能力、检验结果等进行重点核查。

来源:Internet