您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-05 09:36
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:14条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.德琪医药SINE抑制剂selinexor韩国申报上市。德琪医药宣布已在韩国递交了合作品种selinexor(XPOVIO®)联合低剂量地塞米松的新药上市申请,用于治疗复发难治性多发性骨髓瘤以及单药治疗既往接受过至少2线治疗的复发难治性弥漫性大B细胞淋巴瘤。Selinexor是全球首款且唯一一款口服型SINE化合物,由Karyopharm Therapeutics开发,也是首款获FDA批准用于治疗多发性骨髓瘤与弥漫性大B细胞淋巴瘤的药物。Selinexor已于2020年10月在韩国被授予孤儿药资格。
2.扬子江罗库溴铵注射液申报上市。扬子江旗下海尼药业罗库溴铵注射液4类仿制上市申请获CDE受理。罗库溴铵注射液是N.V.Organon公司开发的一种新型非去极化肌肉松弛剂,为全身麻醉辅助用药,用于常规诱导麻醉期间气管插管,以及维持术中骨骼肌的神经肌肉阻滞。该品种共有8家企业拥有生产批件,其中仙琚制药市场份额占比最大。在中国公立医疗机构终端该品种销售额已突破5亿元。
3.赛诺菲启动BTK抑制剂国际Ⅲ期试验。赛诺菲在中国启动一项BTK抑制剂SAR442168治疗原发进展型多发性硬化(PPMS)的国际Ⅲ期临床。该项研究由复旦大学附属华山医院神经内科全超博士担任主要研究者,目标入组人数为中国境内20人,国际990人。研究主要终点为6个月确认的残疾进展。此前,该药物已在治疗复发型多发性硬化(MS)患者的Ⅱb期临床中获积极结果,使患者大脑中新增和增大的Gd-T1病变数量减少了85%。
4.康方生物CD47单抗国内启动临床。康方生物CD47单抗AK117在国内登记启动一项Ⅰ期临床。这是AK117首次在国内启动临床,将评价AK117在晚期实体瘤或淋巴瘤患者中的安全性、药代动力学和抗肿瘤疗效。据悉,AK117通过其独特的结构,在保留抗肿瘤活性同时,消除了红细胞凝集作用,并显著降低其介导的巨噬细胞对红细胞吞噬活性,有望成为临床更佳的抗CD47药物。AK117目前正在澳洲进行临床开发。
5.中国学者发现比瑞德西韦效果更好的新冠药物。发表于 PLOS Computational Biology 杂志上的一篇来自中国科学院深圳先进技术研究院魏彦杰团队的最新研究论文显示,研究团队通过AI计算机筛选,发现原本用于治疗淋巴瘤的化疗药物Folotyn(普拉曲沙) 可能是治疗新冠肺炎的有效药物。体外实验表明,在相同的实验条件下,普拉曲沙比瑞德西韦更有效抑制新冠病毒复制。
6.2020版新型抗肿瘤药物临床应用指导原则发布。《新型抗肿瘤药物临床应用指导原则(2020年版)》12月30日在医政医管局官网正式发布,规范国内可及、各专科、各种新型抗癌药物的临床合理应用。新版指导原则涉及24个瘤种、115种肿瘤药;在2019版基础上新增食管癌、骨巨细胞瘤、腺泡状软组织肉瘤、透明细胞肉瘤、其他晚期软组织肉瘤和头颈部鳞状细胞癌6个瘤种,新增抗肿瘤新药适应症27个(同一药物拓展适应症重复计数)。
国际药讯
1.世卫组织颁发首个新冠疫苗紧急使用认证。辉瑞与德国BioNTech联合开发的新冠疫苗获世卫组织颁发的首个紧急使用认证。世卫组织免疫战略咨询专家组将于2021年1月5日召开会议,根据2020年9月发布的新冠疫苗接种人群总体优先次序建议,为该产品在人群中的使用制定具体政策和建议。该疫苗需要在零下60至零下90摄氏度低温下存储。将给部署工作带来挑战性。
2.法布里病疗法pegunigalsidase alfa公布Ⅲ期研究结果。Protalix BioTherapeutics和Chiesi Global Rare公司联合公布pegunigalsidase α(PRX-102)治疗法布里病Ⅲ期研究BRIDGE的最终结果。由阿糖苷酶α转换为PRX-102治疗后,发生肾病进展或快速进展的患者减少,大多数患者在疗法转换后达到稳定状态。以平均年估计肾小球滤过率测定,患者肾功能获得显著改善(转换前:-5.90 mL/min/1.73m2/year;转换后:-1.19 mL/min/1.73m2/year)。研究中,患者对PRX-102的耐受性良好。有20例(n=22)完成了12个月的持续治疗,其中18例患者选择入组长期扩展研究,并继续接受PRX-102治疗。
3.阿尔茨海默(AD)激越突破性药物AXS-05进入Ⅲ期临床。中枢神经系统(CNS)创新药物研发公司Axsome Therapeutics启动一项评估AXS-05(右美沙芬/安非他酮调释剂)治疗AD激越(agitation)的Ⅲ期研究。AXS-05是一种新型口服NMDA受体拮抗剂,具有多模式活性,目前正在临床中评估治疗抑郁症和其他CNS疾病的潜力。FDA已授予AXS-05治疗AD激越和治疗重度抑郁症(MDD)的二个突破性药物资格,以及治疗难治性抑郁症(TRD)和AD激越的快速通道资格(FTD)。
4.新型AAK1抑制剂启动第二项概念验证II期研究。Lexicon制药口服小分子AAK1抑制剂LX9211治疗带状疱疹后神经痛(PHN)的II期临床RELIEF-PHN-1启动对患者给药治疗。这是LX9211的第二项概念验证研究,拟招募大约74例患者,评估LX9211治疗的有效性、安全性和药代动力学。主要疗效终点是根据11分数字评分量表(NRS)从基线检查(第1天)到第6周的平均每日疼痛评分(ADPS)的变化。
医药热点
1.国家短缺药品清单发布。近日,国家卫健委等12部门联合发布《关于印发国家短缺药品清单的通知》。其中国家短缺药品清单共有6个品种(甲氨蝶呤、垂体后叶注射液、苄星青霉素、米托蒽醌、新斯的明、硫代硫酸钠),侧重在应对解决生产供应端短缺问题,保障药品供应。国家临床必需易短缺药品重点监测清单共有57个品种,侧重在临床必需且不可替代或不可完全替代、存在供给短缺风险的药品。
2.北京已启用220个新冠疫苗接种点。1月3日,北京召开第200场新冠肺炎疫情防控工作新闻发布会。北京市卫健委新闻发言人高小俊在会上表示,北京市目前已启动使用220个新冠疫苗接种点,新冠疫苗接种工作总体平稳有序。1月1日至2日,北京市共接种新冠疫苗73537剂,未发生严重不良反应。
3.沈阳两家医疗机构被吊销执业许可证。沈阳疫情防控新闻发布会通报:沈阳皇姑秀水门诊部、沈阳谱康医院有限公司在执业过程中,未严格执行落实相关规定、未按要求采取有效的疫情防控措施,导致新冠疫情传播。皇姑区卫生健康局依据规定,对这两家机构给予吊销《医疗机构执业许可证》的行政处罚,依法履行相关程序;对相关人员,将依据相关法律法规,继续调查处理。
股市资讯
【复星医药】复宏汉霖与Intas签订《License Agreement》,合作达成正式协议。复宏汉霖拟授予Intas子公司Accord的HLX-02在美国、加拿大独家商业化及相关权利的许可,付款安排包括2700万美元首付款+不超过1300万美元研发注册里程碑付款+销售里程碑付款+18%-50%的销售提成。
【上海医药】盐酸二甲双胍片及硝酸甘油片通过仿制药一致性评价。
【恒瑞医药】罂粟乙碘油注射液获批增加适应症“成人肝细胞癌中期患者的动脉化疗栓塞治疗”。
审评动向
2. FDA最新获批情况(北美01月03日)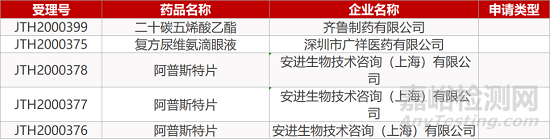
暂无
- The End -

来源:药研发


