您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-15 09:30
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
英国NICE批准阿斯利康肺癌疗法Tagrisso。上周五,英国国家卫生与保健评价研究院(NICE)撤销了早先对阿斯利康的第三代EGFR-TKI Tagrisso(Osimertinib)的拒绝决定,同意批准Tagrisso纳入英国国家医疗服务体系(NHS),用于非小细胞肺癌(NSCLC)已开始扩散到身体其他部位且尚未接受癌症治疗的患者;用于携带EGFR基因(EGFR-T790M)突变、最初治疗失败后、肿瘤细胞开始扩散的NSCLC患者。此前遭拒主要是Tagrisso缺乏成本效益,阿斯利康提供新的商业计划解决了这一问题。
国内药讯
1.普利改良型新药左乙拉西坦颗粒申报上市。普利药业2.2类改良型新药左乙拉西坦颗粒上市申请获CDE受理。左乙拉西坦是优时比研发的一种新型抗癫痫药物,属于吡咯烷酮衍生物。目前,该药已有四种剂型在国内获批上市,包括普通片剂、缓释片、口服液体剂、注射剂。该剂型尚无其他企业在研。目前,该品种获批的国内厂商有京新药业、普洛康裕、信立泰等。2018年左乙拉西坦片全国等级医院销售额约人民币8.94亿元。
2.罗氏重磅血友病新药4项上市申请拟纳入优先审评。罗氏艾美赛珠单抗注射液(Hemlibra)4项新药上市申请获CDE纳入拟优先审评公示名单。这是一款IXa/X双特异性抗体,是首款获得FDA批准治疗体内含或不含因子VIII抑制物的A型血友病预防药。在中国,艾美赛珠单抗是临床急需境外新药品种之一,已于2018年获NMPA加速批准上市,用于治疗存在凝血因子Ⅷ抑制物的A型血友病。
3.德琪SINE抑制剂ATG-010中国临床新进展。德琪医药口服选择性核输出抑制剂(SINE)ATG-010(selinexor)中国Ib期临床(TOUCH)完成首例患者给药。该试验评估ATG-010联合ICE或GEMOX化疗方案序贯ATG-010(selinexor)单药维持治疗复发难治性外周T细胞淋巴瘤和NK/T细胞淋巴瘤患者中的安全性、耐受性和初步疗效。ATG-010是德琪医药和Karyopharm公司的合作品种,已获FDA批准用于难治/复发性多发性骨髓瘤和难治/复发性弥漫性大B细胞淋巴瘤适应症。
4.歌礼子公司在美递交FXR激动剂临床申请。歌礼旗下甘莱制药已向FDA递交非酒精性脂肪性肝炎(NASH)候选药物ASC42的临床试验申请。ASC42是一款best-in-class的FXR激动剂,已在动物实验中表现出对肝脂肪变性、炎症和纤维化的显著改善。据悉ASC42可单独使用,也可以与甘莱制药NASH管线中另外两个处于临床阶段的候选药物ASC40或ASC41联合使用。其中,ASC40是一种口服FASN抑制剂,ASC41是一种口服THR-ß激动剂。
5.石药Cx43抑制剂ALMB-0166在中国申报临床。石药集团旗下上海恩乐迈生物提交的1类新药ALMB-0166注射液临床申请获CDE受理。ALMB-0166是一款First-in-class的Cx43靶向抗体药物,由AlaMab公司自主研发,拟用于治疗急性脊髓损伤,缺血性中风及其它多种临床急需的神经性疾病。该药目前正在澳大利亚启动临床试验,其用于治疗急性脊髓损伤(SCI)适应症也已获FDA授予的孤儿药资格认定。
6.信达生物CD47单抗提交临床试验新申请。信达生物CD47单抗IBI188的临床试验申请获CDE受理,这是IBI188在国内的第四项临床试验申请。此前,信达生物围绕IBI188单抗在国内启动了3项临床试验,适应症包括了初诊中高危骨髓增生异常综合征、急性髓系白血病、晚期恶性肿瘤,IBI188已进入了中美两地同步临床的阶段。截至目前,全球范围内尚无CD47抗体获批上市。
国际药讯
1.帕金森病基因疗法长期临床结果积极。Neurocrine Biosciences和Voyager公司联合开发的在研基因疗法NBIb-1817(VY-AADC),在治疗帕金森病患者的Ⅰb期临床PD-1101中获积极结果。患者接受一次NBIb-1817治疗3年后,患者的关闭期平均下降0.15-1.91个小时(基线为4.28-4.93小时),开放期长度平均提高0.26-2.23个小时(基线为10.32-10.46小时);较高剂量的队列2和队列3患者中,每日口服左旋多巴的等同剂量平均降低322.0和441.2 毫克/天(基线为1507.0和1477.0毫克/天)。
2.口服抗生素tebipenem HBr治疗cUTI达Ⅲ期终点。Spero公司口服抗生素tebipenem HBr(替比培南酯氢溴酸盐,SPR994)治疗复杂性尿路感染(cUTI)和急性肾盂肾炎(AP)的关键III期ADAPT-PO获阳性顶线结果。与静脉给药厄他培南相比,tebipenem HBr的疗效达非劣效性标准,两组的ORR分别为58.8%和61.6%(-3.3%;95%CI:-9.7,3.2;非劣性[NI]界值为-12.5%),两组临床治愈率均较高(>93%)。各治疗组对最常见泌尿系统致病菌的病原微生物反应是平衡的。tebipenem HBr的耐受性良好,其安全性与厄他培南相似。
3.诺华别构抑制剂asciminib达Ⅲ期临床终点。诺华别构抑制剂asciminib(ABL001)在Ⅲ期临床研究(ASCEMBL)中达到主要终点指标。该研究比较asciminib与bosutinib治疗费城染色体阳性慢性期慢性粒细胞白血病(CML-CP)的疗效,入组患者之前至少接受过2次酪氨酸激酶抑制剂(TKI)治疗,且表现耐药或者对药物不耐受。临床研究结果显示:在24周主要分子反应(MMR)率方面,asciminib明显优于bosutinib。
4.辉瑞/BioNTech计划扩展新冠疫苗关键性临床试验。辉瑞和BioNTech公司已向FDA提交了一份修正方案,计划将其候选新冠mRNA疫苗BNT162b2的关键性Ⅲ期临床的招募人数从3万名增加到4.4万名。BNT162b2的Ⅲ期临床在7月28日启动,预计下周将达到注册3万名受试者的最初目标。这一修正方案将允许进一步增加参与人群的多样性,包括16岁以上的青少年,以及慢性、稳定的HIV、丙肝或乙肝病毒感染者。两家公司期望在10月底之前获得有关于疗效的结论性数据。
5.吉利德将囊获“first-in-class“抗体偶联药物。吉利德科学拟斥资约210亿美元收购Immunomedics公司,获得其具first-in-class潜质的Trop-2靶向抗体偶联药物Trodelvy。Trodelvy(sacituzumab govitecan-hziy)已获FDA的加速批准,用于治疗既往接受过至少2种疗法的转移性三阴性乳腺癌。此外,Trodelvy还在Ⅲ期临床中,作为三线疗法,治疗HR+/HER2-乳腺癌患者,以及在注册性Ⅱ期临床中治疗膀胱癌患者。Immunomedics计划今年第四季度提交其补充上市申请,支持Trodelvy获得FDA的全面批准。
医药热点
1.四位生物科学家获“科学突破奖”。“科学突破奖”基金会宣布了2021年科学突破奖的获奖名单。今年有四位科学家获得生命科学科学突破奖,他们分别是华盛顿大学和HHMI(Howard Hughes Medical Institute)的David Baker博士。哈佛大学和HHMI的Catherine Dulac博士,香港中文大学的卢煜明博士,和美国国立卫生研究院的Richard J. Youle博士。今年科学突破奖总计将颁发1875万美元奖金,支持科学家们致力于解决最重大和最基本的科学问题。
2.德国国家拳击队全员感染新冠。德新社12日报道,德国国家拳击队在奥地利朗根费尔德训练期间,拳击队18名运动员以及7名教练和领队全部感染新冠病毒,但没有重症患者。目前,拳击队在奥地利隔离,隔离结束回国后将接受全面体检。他们是否能参加定于10月14日至18日举行的科隆杯拳击赛将取决于他们的康复状况。
3.香港新冠普检累计找出26例新确诊病例。为期14日的香港“普及社区检测计划”将于9月14日晚结束,截至9月13日晚,已有171.9万人接受采样,累计找出26例新确诊病例,至少截断10条病毒传播链。若以每例确诊者最多可以传播4人计算,单是普及社区检测发现的20多例确诊者,连同二三代传播,估计已至少阻止160人染疫。
4.知名大三甲彻查医生讲课费。据医药招聘消息,近日,武汉某三甲医院启动了严格的审查活动,要统计所有医生去年临床讲课费的情况。据了解,每个医生的账户都会被系统调出来进行仔细的核查。如果查到医生账户上哪一笔费用是哪家公司支付的,医院纪律检查委员会将发协助调查函给相应的药企,要求公司逐人逐笔提供相关费用发生时的邀请函、授课课件、现场照片、劳务协议、转账卡号、涉及金额、会务行程安排等相关证明材料。
股市资讯
【仟源医药】子公司嘉逸医药收到国家药监局签发的化学药品“利伐沙班片”的《药品注册批件》,同时原料药利伐沙班也获国家药监局关联审评通过,已批准在上市制剂中使用。药品主要用于择期髋关节或膝关节置换手术成年患者,以预防静脉血栓形成(VTE),亦可用于一种或多种危险因素的非瓣膜性房颤成年患者,以降低卒中和全身性栓塞的风险。
【上海医药】子公司新亚闵行盐酸克林霉素胶囊通过仿制药一致性评价。药品主要适用于敏感厌氧菌引起的严重感染;2019年该药品口服剂型医院采购金额为5.54亿元,其中胶囊剂医院采购金额为1,901万元。截至本公告日,公司针对该药品的一致性评价已投入研发费用约693.64万元。
【华润双鹤】全资子公司华润赛科缬沙坦氢氯噻嗪片通过仿制药质量和疗效一致性评价,该药品适用于治疗单一药物不能充分控制血压的轻-中度原发性高血压;2019年中国缬沙坦氢氯噻嗪片销售总额11.5亿元,华润赛科该药品销售收入为1.31亿元;华润赛科就该药品开展一致性评价累计研发投入为1,725.33万元。
审评动向
1. CDE最新受理情况(09月14日)
2. FDA最新获批情况(北美09月11日)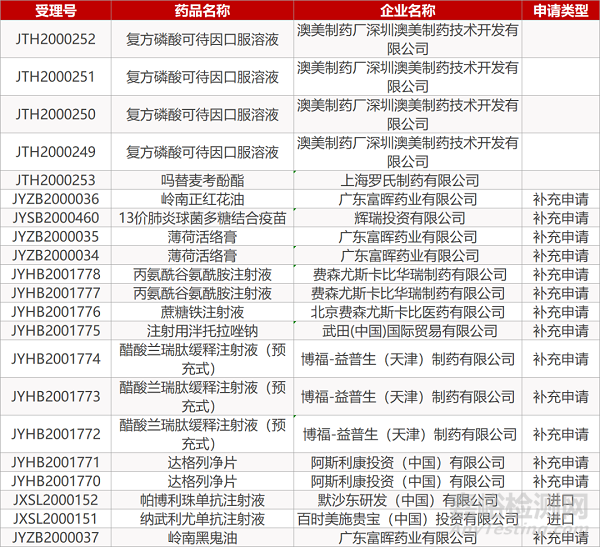
暂无
- The End -

来源:药研发


