您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-02-22 10:41
1、植入产品的定义
国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助外科手术,器械全部或者部分进入人体或自然腔道中;在手术过程结束后长期留在体内,或者这些器械部分留在体内至少30天以上。
我国已成为仅次于美国的世界第二大医疗器械市场,植入医疗器械属于第三类医疗器械的高端产品,是医疗器械产业中重要的产品门类。
2、可植入材料分类及介绍
可植入人体的材料按材料种类可分为:金属材料、高分子材料、无机材料、复合材料、生物材料等。按材料与组织的相互作用关系可分为:可降解材料和非降解材料。
可降解材料是指在生物体内能被逐渐破坏(包括形态、结构破坏和性能蜕变),其降解产物能被机体吸收代谢、或自行分解而消失。在这个过程中,不应产生对人体有害的副产物。
对于体内可降解的高分子材料来言,一般分为天然与合成两大类。天然高分子材料包括明胶、甲壳素、透明质酸、纤维素等;合成高分子材料包括聚α-羟基酸、聚酸酐、聚原酸酯、聚磷腈等,其中聚α-羟基酸是目前可降解吸收材料领域研究和应用最为广泛的高分子材料。
2.1 天然高分子材料
2.1.1 明胶
没有固定的结构和相对分子量,由动物皮肤、骨、肌膜、肌魅等结缔组织中的胶原部分降解而成为白色或淡黄色、半透明、微带光泽的薄片或粉粒;是一种无色无味,无挥发性、透明坚硬的非晶体物质,可溶于热水,不溶于冷水,但可以缓慢吸水膨胀软化,明胶可吸收相当于重量5-10倍的水。
2.1.2 甲壳素
甲壳素(Chitin)又名甲壳质、几丁质,化学名为(1,4)-2-乙酰胺-2-脱氧-β-D-葡聚糖,主要存在于虾、蟹、蛹及昆虫等动物外壳以及菌类、藻类植物的细胞壁中。壳聚糖(Chitosan)是甲壳素脱乙酰基后的产物,是甲壳素最基本、最重要的衍生物。下图是甲壳素、壳聚糖分子结构示意图:
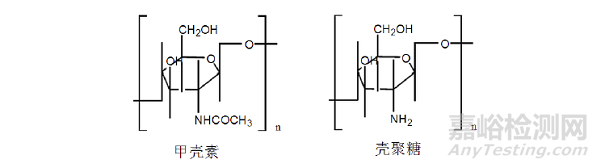
纯净的甲壳素和壳聚糖均为白色片状或粉状固体,常温下能稳定存在。因壳聚糖分子中带有游离氨基,在酸性溶液中易成盐,呈阳离子性质,是至今为止发现的唯一带阳离子电荷的碱性多糖,具有良好的抗菌止血作用。
2.1.3 透明质酸
透明质酸HA是由(1,3)-2-乙酰氨基-2-脱氧-β-D-葡糖-(1,4)-O-β-D-葡糖醛酸双糖重复单位所组成的直链多聚糖,分子结构示意图如下:
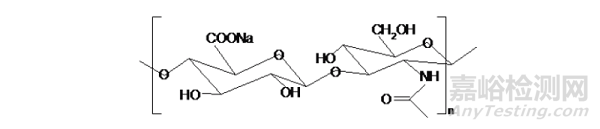
HA对强酸、强碱、热、自由基及透明质酸酶敏感,容易发生降解等特性,限制了它用于制备对硬度、机械强度和稳定性有一定要求的生物材料。水分子通过氢键被固定在透明质酸分子形成的网络中,不易流失。
研究表明,透明质酸能够吸附约为其本身重量1000倍的水分,是目前自然界中发现的保水性最好的天然物质。不过天然透明质酸在人体中的维持周期极短,因此一般采用物理或化学交联的方法来增加透明质酸抗酶解的能力,延长其在体内的保持时间。
2.1.4 纤维素
纤维素(Cellulose)是由葡萄糖组成的大分子多糖。不溶于水及一般有机溶剂。是植物细胞壁的主要成分。纤维素与氧化剂发生化学反应,生成结构不同的氧化纤维素,具有良好的止血作用;经羧甲基化后得到的是羧甲基纤维素(CMC),其水溶液具有增稠、成膜等作用,在医学领域应用非常广泛。
2.2 合成高分子材料
在这一类高分子材料中,聚原酸酯、聚酸酐、聚磷酸酯等材料,表面溶蚀型降解材料,主要用于药物控释体系,在此不多介绍。聚α-羟基酸类材料具有良好的生物相容性和生物可降解性,是作为第一批被FDA批准用于临床的、也是迄今研究最广泛、应用最多的化学合成类可降解高分子材料。降解产物为乳酸和羟基乙酸,乳酸在体内最终以二氧化碳和水的形式排出。羟基乙酸可参与三羧酸循环或以尿的形式排出体外。
2.2.1聚羟基乙酸(PGA)
PGA,又称聚乙醇酸、聚乙交酯,是乙醇酸的聚合物,具有简单规整的线性分子结构,是简单的线性脂肪族聚酯,结晶度较高,一般为40% ~80%,不溶于常用的有机溶剂。
分子结构示意图如下:
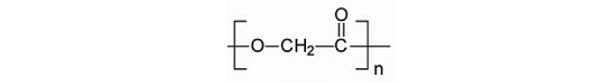
PGA具有良好的生物降解性和生物相容性,其降解产物为H2O和CO2。早在70年代,用其作为材料的缝合线既已商品化,目前已开发有骨折固定材料、人工血管和组织修复网架。
2.2.2 聚乳酸(PLA)
PLA,又称聚丙交酯,是以乳酸为单体得到的聚合物,热稳定性好,加工温度170~230°C,有良好的抗溶剂性,可用多种方式进行加工,如挤压、纺丝、双轴拉伸,注射吹塑。分子结构示意图如下:
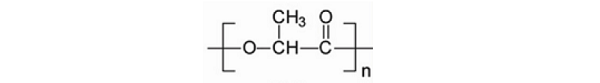
PLA具有良好的生物降解性和生物相容性,其降解产物为H2O和CO2。它是手性分子,存在两种立体异构体,有4种不同形态的聚合物,即PLLA、PDLA、D,L-PLA(PDLLA)以及meso-PLA。PLLA和PDLA是半结晶状高分子,机械强度好;D,L-PLA是无定型高分子,常用作药物控释载体。
2.2.3 羟基乙酸-乳酸共聚物(PLGA)
PLGA由乳酸和羟基乙酸聚合而成的非定型聚合物,其玻璃化温度在40-60 °C之间。纯的乳
酸或羟基乙酸聚合物比较难溶,与之不同的是,PLGA展现了更为广泛的溶解性,它能够溶解于更多更普遍的溶剂当中。分子结构示意图如下:
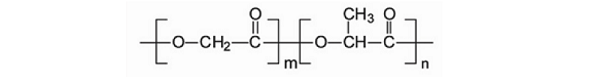
PLGA具有良好的生物相容性,降解产物是乳酸和羟基乙酸,同时也是人代谢途径的副产物,所当它应用在医药和生物材料中时不会有毒副作用。通过调整单体比例,可改变PLGA的降解时间。
2.2.4 聚己内酯(PCL)
PCL由ε己内酯单体开环聚合而成,属于聚合型聚酯,其分子量与歧化度随起始物料的种类和用量不同而异。分子结构示意图如下:
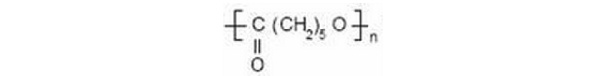
PCL生物相容性很好,细胞可在其基架上正常生长,降解产物为H2O和CO2。因存在较长的疏水性亚甲基链段,故降解速度比PGA和PLA减慢得多。体内完全吸收和排除需要2-4年。
3、降解机制
可降解吸收高分子材料的降解主要为化学水解和酶解两大类,前者是化学反应,后者是生化反应。通过水解或者酶解反应,从而使高分子主链断裂,分子量逐渐变小,以致最终成为可被人体吸收的单体或代谢成H2O和CO2。
聚酯等大部分合成高分子材料以化学水解为主,降解速率主要受到主链官能团的控制。对于固体材料的降解有本体降解和表面溶蚀之分。如果材料的降解从表面开始,一层一层的被剥离,则为表面溶蚀型;如果实心材料的内外同时降解,则为本体降解。聚乳酸为本体降解,因为疏水性不够强。聚酸酐等材料表面疏水性极强,导致其表面的降解速率明显大于水扩散到其内部的速率,为典型的表面溶蚀。
天然高分子材料则以酶解为主,降解速率主要受酶的类型、浓度以及材料的序列的影响。
4、应用现状及研发方向
随着人类生活质量的提高,世界各国对各种医用产品的需求越来越大,市场前景广阔,植入医疗器械产业在世界各国尤其是发达国家颇受重视。近年来,越来越多的可吸收产品被开发出来并成功的应用于人体。
4.1 生物可吸收血管支架
血管支架是指在管腔球囊扩张成形的基础上,在病变段置入内支架以达到支撑狭窄闭塞段,减少血管弹性回缩及再塑形,保持血流通畅的目的。完全生物可吸收支架研究最多的是冠脉支架,被称为冠脉介入的“第四次革命”,将有可能主导未来10年的冠脉支架市场。
用于可吸收支架的可降解高分子材料主要有聚乳酸、聚羟基乙酸、羟基乙酸-乳酸共聚物、乳酸-己内酯共聚物、聚氨酯等,降解时间从可几个月到三年以上。
4.1.1 目前已上市及处于临床研究阶段的产品
1)Absorb药物洗脱生物可吸收血管支架(ABBOTT Vascular),于2011年获得CE认证,2012年开始在全球30多个国家正式销售,是首个已上市的生物可吸收药物洗脱支架,其工作原理与金属支架相似,即通过恢复血流量发挥作用,用于治疗冠状动脉疾病(CAD)。该产品以PLLA为支架材料,以带依维莫司Everolimus的PDLLA为支架内层构成。主要通过化学水解作用降解,降解产物被巨噬细胞吞噬,完全降解时间约2~3年。
2)DESolve 生物可吸收支架(Elixir Medical),处于临床试验研究阶段。以PLLA为支架材料,含有两种新型抗增殖药物(Novolimus和Myolimus)作为涂层,完全降解时间约2~3年。
3)IDEAL生物可吸收支架(Bioabsorbable Therapeutics,Inc),处于临床前研究阶段。以含有水杨酸的聚酸酐为骨架,带有西罗莫司(Sirolimus)涂层。
4)REVA和ReZolve生物可吸收支架(REVA Medical),处于临床研究阶段。以酪氨酸类聚碳酸酯为骨架材料,带有西罗莫司(Sirolimus)涂层,并采用新颖的独特滑行、螺旋锁设计,从而具有更强的径向支撑力,减少了支架的急性回缩率。完全降解时间约18~24个月。
5)Igaki-Tamai支架( Kyoto Medical Planning Co. Ltd.),是第一个应用于人体的完全可降解支架,2007年获CE认证,仅在欧洲获准用于外周血管的介入治疗,用于心血管的临床试验仍在进行之中。该产品以PLLA为骨架材料,没有药物涂层,完全降解时间约2~3年。
4.1.2 研发前景
当前,生物可降解支架在临床中的应用仍被限制,仅仅用于简单的冠状动脉病变。随着未来临床试验的不断进行,生物可降解支架的有效性及安全性将得到系统的评价,使其能广泛应用于临床治疗。就目前的研究结果看,以下问题有待于解决:
1)改善支架强度,提高径向支撑力。
2)减轻局部炎症反应。
3)降低亚急性期和晚期的血栓形成率。
在材料方面,PLA尽管具有良好的生物相容性,但降解后的乳酸会刺激局部血管引起炎症反应。可考虑采用己内酯、三亚甲基碳酸酯等进行共聚改性,降低羧基含量;或者引入碱性基团改性聚合物,以中和聚乳酸降解产物。一些新的聚合物的应用如酪氨酸衍生的聚碳酸酯、水杨酸基聚酐和聚氨酯化合物等,可改进支架的机械性能。
4.2 面部注射填充类产品
随着年龄的增长,皮肤中的透明质酸含量逐渐减少,导致真皮脱水,皱纹加深,失去弹性。
用于面部注射填充的可吸收材料主要包括:透明质酸、羟基磷灰石钙、肉毒素、聚乳酸等。
4.2.1 交联透明质酸
由于天然透明质酸在人体中的维持周期极短,不能保证填充修饰的长期效果,因此一般采用物理或化学交联的方法来增加透明质酸抗酶解的能力,延长其在体内的保持时间。通常采用的交联剂有BDDE和DVS。
国外通常把透明质酸皮肤填充剂按物态来分,分为单相和双相。双相的产品是由交联透明质酸凝胶颗粒和非交联透明质酸溶液组成(凝胶颗粒状和液体状),单相的产品通常就是单一的交联透明质酸凝胶(液体状)。
有代表性的国外产品如美国Genzyme公司的Hylaform系列,采用DVS交联剂,为双相产品;瑞典Q-Med公司的Restylane/ Perlane系列产品,采用BDDE交联剂,为双相产品。而且这两个公司的产品后续都增加了含0.3%利多卡因的规格。德国Adoderm公司的Varioderm系列产品,采用DVS交联剂,交联度高达70-90%,为单相产品。
国内产品目前也有十几个品牌上市,体内存留时间一般为6-12个月。CFDA批准的适应症均为“面部真皮组织中层至深层注射以纠正中重度鼻唇沟皱纹”。与国内不同的是,FDA对某些型号的产品增加了“21岁以上的患者粘膜下层的注射丰唇”。
4.2.2聚乳酸微球
法国Sanofi-Aventis公司生产的Sculptra,主要成分为聚PLLA,2009年获美国FDA批准用于改善脸部皱纹。它是由PLLA微球、羧甲基纤维素、甘露醇组成,使用前加入无菌水形成悬浮液后使用,体内存留时间可达2年。其缺点是使用时溶解相对较慢,注射后有可能会出现皮下结节。
通过在PLLA上引入聚乙二醇或甲氧基聚乙二醇,形成嵌段共聚物。聚乙二醇类亲水性好,制成微粒后,裸露在微粒表面的聚乙二醇基团会与水亲和,降低表面张力,可防止加工过程中漂浮于水相表面而分散不均。植入人体后亲水性增加,有利于细胞粘附增殖,使微粒不易迁移或聚
集,降低炎症反应级别和发生几率。
4.3 可吸收疝修补产品
传统的小孔径补片因补片较坚硬,术后腹壁的顺应性受限,增加病人异物感。因此可吸收补片和部分吸收的复合补片成为研究趋势。
4.3.1可吸收补片
这类补片主要是PGA和PLGA网片,3个月左右可被完全吸收。临床上最早报道用于修补受伤的脾和肾。此类材料不能单独作为腹部疝的永久性修补材料,可作为腹膜缺损修补材料和有污染创面的腹部切口疝缺损的暂时性修补材料,可以在不引起并发症的情况下临时恢复腹壁连续性,帮助患者度过疾病危险期,再用不可吸收的补片进行二期修补。目前已上市产品有:Dexon补片(PGA)和Vicryl补片(PLGA)。
4.3.2 可吸收复合补片
这类材料的设计是以聚丙烯网为骨架,然后在其网状结构的表面通过编织或化学结合的方法添加可吸收的生物材料。
其目的是减少异物(聚丙烯)的用量,提高补片的柔软度和重量。补片上的可吸收材料一般在体内2周内开始降解,随后补片的骨架网被间皮层覆盖。目前国际市场应用的可吸收材料复合型补片主要有以下几种:
1)Parietex(SOFRADIM PRODUCTION)补片:由多股聚酯纤维与纯化的氧化胶原蛋白I组成,以可吸收、防粘连聚乙二醇和甘油覆盖。
2)Proceed Surgical mesh(Ethicon,Inc)补片:具有4层结构,有聚丙烯网片嵌入到两层可吸收的聚对二氧环己酮(PDS),下方再加一层可吸收的氧化再生纤维素膜。该补片在植入后14天内开始裂解,6个月左右完全吸收。
3)Sepramesh IP(Genzyme Biosurgery)由两层结构组成,一层是大孔径的聚丙烯,另一层是PGA,在PGA表面覆盖含有透明质酸钠、羟甲基纤维素和聚乙二醇的水凝胶。该补片可吸收聚合物层的可吸收成分在48小时后变成胶样物,但仍然在补片上存留约7天,在28天后完全吸收。
新的可吸收修补材料发展方向是需要同时具有轻量型补片的大孔径结构,又具有良好的生物相容性、可吸收性和力学性能可控性。
4.4 可吸收结扎夹
最早用于外科临床结扎的为可吸收性缝线,继之出现了缝合钉、结扎夹等。可吸收性的结扎夹的应用较传统的金属夹显示了较大的优越性并得到了充分的肯定。
目前已上市的国外产品主要有强生公司的可吸收生物夹,是由聚对二氧环己铜(PPDO)制成的V型夹,完全降解时间约为180天;泰科公司的Lapro-ClipTM可吸收结扎夹,是双层结构,内层为PGA和三亚甲基碳酸酯的共聚物,降解时间约为90天,外层材料为聚甘醇酸,降解时间约为180天。国内目前只有一家上市的产品,双层结构,内层为PPDO,外层为聚甘醇酸,降解时间约为180天。
可吸收止血结扎夹是未来这类产品的趋势,也是目前的研究热点及研发方向。目前急需解决的是产品的原料制备问题及产品结构的优化。
4.5 骨科植入物
在骨科领域,由于严重创伤、骨肿瘤、骨髓炎等多种原因所致的骨缺损十分常见。在许多情形下,人体骨并不能实现自身修复,例如骨组织坏死、骨关节创伤,人工骨替代材料修复骨缺损成为医学重点。人工合成的聚合物可以准确地控制其分子量、降解时间以及其它性能,但却没有天然材料所包含的许多生物信息(如某些特定的氨基酸序列),使其不能与细胞发挥理想的相互作用。
目前已上市的聚乳酸类骨科植入物主要有芬兰Bioretec公司的可吸收骨接合植入物,是由聚(L乳酸-羟基乙酸)制成,用于骨折固定、骨移植等;芬兰Inion公司的可吸收骨内固定系统,
由聚(L乳酸-DL乳酸),聚(L-乳酸,三亚甲基碳酸酯)制成,包括骨板、螺钉和接骨棒等;美国Biomet Microfixation公司的可吸收骨内固定体,用于中面部或颅面部骨骼重塑;美国Codman & Shurtleff公司的可吸收固定系统Craniosorb,由PDLA,PCL,聚对二氧环己酮PPDO,PLLA制成,用于颅面骨的重建及固定。
随着组织工程学的发展,人们对人工骨的研发方向主要有:
1)生物活性物质的来源及其快速稳定的体外培养增殖。
2)基质材料的生物力学强度,降解率及其与生物活性物质的亲和力。
3)将控释系统引入基质材料,使基质材料负载的生长因子持续释放,利于细胞的生长和分化,发挥其最佳的成骨能力。
4.6 神经导管
针对外周神经缺损,使用可吸收人工神经导管进行桥接,可避免自体神经移植。另外,导管可以起到保护作用,预防神经瘤形成和纤维组织内生。用于人工神经导管的材料主要包括聚乳酸、聚乙醇酸、壳聚糖等。
Synovis Micro Companies Alliance, Inc生产的可吸收神经套接管GEM Neurotube,于1999年被美国FDA批准上市并运用于临床,是由PGA制成的网状管,管壁呈波纹状。该产品通过水解过程可在3-6个月内被人体吸收,用于修复指神经缺损和恢复感觉功能神经的缺损。
Polyganics BV公司生产的 NEUROLAC. Nerve guide,2003年获得美国FDA批准,2004年获得欧盟CE认证,是由PDLLA- PCL共聚物制成的导管。用于缺损2cm内外周神经的重建。
神经导管的进一步研发方向是促进神经细胞的再生,解决神经缺损较大的情况下的修复问题。加入生长因子,如何保持活性、使其可以在一定时间内缓慢释放是其中的难点;另外,如何把材料成型为最适合的形状且具有致密光滑的内表面、多空半透的管壁,也将是研究的重点。
4.7 尿失禁填充物
Salix制药公司生产的Deflux,主要成分是以透明质酸为载体的右旋糖苷微球体,球体直径为80μm~200μm,可在内镜下在输尿管膀胱交界进行注射治疗压力性尿失禁。该产品于2014年获得FDA的批准用于治疗压力性尿失禁。透明质酸降解后,糖苷微球体停留在原位3~4年或更长时间。对于治疗压力性尿失禁,临床证明85%的病人得到治愈或显著改善。

来源:山东省药学科学院夏毅然


