您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-30 09:12
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.马应龙聚乙二醇4000散通过一致性评价。马应龙药业聚乙二醇4000散获国家药监局核发的药品补充申请批件,该药品通过一致性评价。聚乙二醇4000散主要用于成人及8岁以上儿童(包括 8 岁)便秘的症状治疗。该药原研药由Ipsen 公司研发(商品名:福松,10g、散剂),于1995年在法国获批用于治疗成人便秘,1999年获批进口中国。2018年该药品在中国公立医疗机构的销售额合计为1.6902亿元。目前该药品国内获批的厂家还有华森制药、赛诺生物药业和华纳大药厂,均已通过一致性评价。
2.卫材吡仑帕奈即将国内上市。日本卫材吡仑帕奈(Perampanel,Fycompa)中国上市申请的办理状态已变更为"在审批"。吡仑帕奈是一种高选择性、非竞争性的AMPA型谷氨酸受体拮抗剂,通过抑制突触后AMPA受体谷氨酸活性,减少神经元过度兴奋,达到预防和治疗癫痫疾病的目的。2012年10月,FDA首次批准吡仑帕奈片剂作为12岁及以上癫痫患者的伴或不伴继发性全身性癫痫发作的部分发作性癫痫的辅助疗法。据悉2018年全国公立医疗机构及药店零售终端抗癫痫药物市场接近50亿元。
3.博晖创新人凝血酶原复合物纳入优先审评程序。博晖创新控股子公司大安制药开发的人凝血酶原复合物的上市申请获国家药监局正式纳入优先审评程序。人凝血酶原复合物主要用于治疗先天性和获得性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ缺乏症(单独或联合缺乏),包括:凝血因子Ⅸ缺乏症(乙型血友病)以及Ⅱ、Ⅶ、Ⅹ凝血因子缺乏症;抗凝剂过量、维生素K缺乏症;肝病导致的出血患者需要纠正凝血功能障碍时;治疗已产生因子Ⅷ抑制物的甲型血友病患者的出血症状等。
4.复宏汉霖PD-1抗体联合方案Ⅱ期临床启动。复宏汉霖抗PD-1单抗注射液 (HLX10) 联合抗VEGF单抗注射液 (HLX04) 治疗晚期肝细胞癌 (HCC) 的Ⅱ期临床首例患者给药。HLX10是一种治疗多种实体瘤的创新型单克隆抗体,单药治疗方案现已进入Ⅱ期临床阶段,HLX10还可联合其他产品开展免疫联合疗法,广泛用于实体瘤治疗。HLX04是贝伐珠单抗的生物类似药。该研究将在经标准治疗后发生疾病进展或不可耐受毒性反应的晚期肝细胞癌患者中评估该联合方案的疗效与安全性。该治疗方案用于晚期实体瘤治疗的国内Ⅰ期临床仍在进行中。
5.西比曼又一款干细胞产品获临床批件。西比曼旗下用于治疗膝骨关节炎的“自体人源脂肪间充质祖细胞注射液”获国家药监局临床试验默示许可。膝骨关节炎是一种常见的慢性关节疾病,又叫做退行性关节炎,主要侵害膝关节软骨、骨和滑膜组织。病发期间患者会出现关节疼痛、肿胀、变形。严重时可以出现膝关节畸形。此前,西比曼申请的异体人源脂肪间充质祖细胞注射液AlloJoin治疗膝骨关节炎已获国家药监局临床批件。
国际药讯
1.Jazz发作性睡病创新疗法达Ⅲ期临床终点。Jazz公司羟丁酸盐的新型药物JZP-258在治疗成年发作性睡病患者的白日过度嗜睡(EDS)Ⅲ期试验中达主要终点和关键性次要终点。结果显示,剂量优化期后,继续接受JZP-258治疗的患者每周猝倒发作的次数与剂量优化期时保持一致,而接受安慰剂治疗的患者每周猝倒发作次数显著增加。在剂量稳定期继续接受JZP-258治疗的患者Epworth嗜睡量表评分中位数显著低于安慰剂组。此外,JZP-258显示出与Xyrem一致的安全性。
2.辉瑞JAK1抑制剂Ⅲ期结果积极。辉瑞公司在研口服小分子特异性JAK1抑制剂abrocitinib在治疗12岁及以上中重度特应性皮炎(AD)患者的第二项关键性Ⅲ期试验中达主要终点和关键性次要终点。结果显示,与安慰剂相比,abrocitinib显著提高患者的研究者总体评估总分(IGA)0/1和至少2分改善的患者比例;显著提高患者的湿疹面积和严重程度指数(EASI)比基线改变至少75%的患者比例;显著提高患者的瘙痒数字评定量表(NRS)评分和特应性皮炎的瘙痒和症状评估(PSAAD)测量的患者改善比例。详细数据将在科学会议和医学杂志上公布。abrocitinib此前已获FDA授予的突破性疗法认定。
3.Enanta公司FXR激动剂Ⅱa期临床成功。Enanta公司FXR激动剂EDP-305治疗非酒精性脂肪性肝炎(NASH)的Ⅱa期研究ARGON-1结果积极。结果显示,在第12周时,2.5mg EDP-305治疗组患者体内的谷丙转氨酶(ALT)水平具统计学意义的显著降低(28U/L),安慰剂组的ALT降低了15U/L(p=0.049);2.5mg EDP-305治疗组的患者肝脂肪含量也发生显著降低(p<0.001),45%的受试者脂肪减少超过30%;与EDP-305用药相关的紧急不良事件(TEAE)大多为轻中度。最常见的TEAE(≥5%)包括瘙痒、恶心等。该公司计划在明年上半年启动Ⅱb期ARGON-2研究。
4.安进/诺华偏头痛药Aimovig遭NICE拒绝。安进/诺华开发的用于预防每月至少有四次偏头痛的新药Aimovig遭英国国家健康与护理卓越研究所(NICE)拒绝用于英国国家卫生服务系统(NHS)。NICE认为没有足够的临床数据证明Aimovig比NICE已推荐批准的Botox肉毒杆菌毒素(艾尔建)更有效;Aimovig的临床数据不能较好地覆盖NHS体系中的相关患者,且对于慢性偏头痛和发作性偏头痛人群的长期疗效尚不清楚。尽管Aimovig的定价约为5,000英镑/年且提供了一项保密折扣,但基于临床数据不足的原因,监管机构认为该疗法不符合成本效益。
5.罗氏PD-L1抗体一线单药治疗NSCLC结果积极。罗氏在ESMO 2019年会上公布其PD-L1单抗Tecentriq单药与顺铂或卡铂和培美曲塞或吉西他滨(化疗)相比,一线治疗非小细胞型肺癌(NSCLC)的Ⅲ期临床IMpower110积极结果。结果显示,Tecentriq在中期分析中达主要终点,与化疗相比,将PD-L1高表达患者的总生存期(OS)提高7.1个月。Tecentriq组中位OS为20.2个月,化疗组为13.1个月(HR=0.595,95%,0.398-0.890,p=0.0106)。在PD-L1中度表达患者群中Tecentriq也显示出总生存益处,其中位OS达到18.2个月(化疗组为14.9个月)。不过,PD-L1中度表达患者的数据未达统计学意义的显著区别。罗氏将继续对PD-L1低表达的患者进行追踪研究。
6.安进KRAS抑制剂治疗结直肠癌疾病控制率92%。在ESMO 2019年会上,安进KRAS G12C抑制剂AMG 510公布其治疗结直肠癌(CRC)和阑尾癌患者的积极结果。在55例可评估患者中(29例CRC患者),12例CRC患者接受剂量为960 mg的AMG 510治疗。其中1例患者达部分缓解,10例患者达疾病稳定,疾病控制率为92%,目前仍有10例患者在接受治疗。在2例可评估的阑尾癌患者中1例达部分缓解,另1例疾病稳定。在9月初的WCLC 2019年会上,AMG 510已公布其治疗携带KRAS G12C突变的非小细胞肺癌患者的积极结果。13例患者接受960 mg AMG 510的治疗,7例达部分缓解,6例达疾病稳定,疾病控制率为100%。
7.ADC与PD-1抗体联合方案一线治疗膀胱癌结果积极。Seattle Genetics/安斯泰来的抗体偶联药物(ADC)enfortumab vedotin与默沙东的PD-1抑制剂Keytruda联用一线治疗晚期膀胱癌结果积极。在这项Ⅰ期临床EV-103中,enfortumab vedotin单药或与Keytruda联用治疗无法接受一线基于顺铂化疗的晚期或转移性尿路上皮癌患者,结果显示,enfortumab vedotin与Keytruda联用缩小大多数癌症患者的肿瘤。ORR达71%(32/45, 95% CI:55.7,83.6)。其中完全缓解率为13%,部分缓解率为58%,22%的患者疾病稳定,疾病控制率达到91%。Enfortumab Vedotin是一款将抗Nectin-4单抗与微管破坏剂MMAE连接起来生成的ADC,FDA已授予其治疗接受化疗和PD-1/L1抑制剂之后疾病仍进展的尿路上皮癌患者的优先审评资格。
医药热点
1.红斑狼疮援助项目启动。由中国初级卫生保健基金会发起的“蓓丽新生”系统性红斑狼疮(SLE)患者公益援助项目正式启动。该项目旨在为符合援助条件的SLE患者提供规范治疗所需的创新药品,项目援助药品注射用贝利尤单抗由葛兰素史克无偿提供。据悉,项目首期计划覆盖全国20家城市100家医院,主要针对因病致贫、因病返贫的低收入患者和低保患者。
2.长三角异地就医门诊费用直接结算系统全面联通。长三角地区异地就医门诊费用直接结算工作阶段总结会召开,上海、江苏、浙江、安徽三省一市的医保局局长在会上共同启动了直接结算系统联通仪式。今后,长三角居民只要通过网上申报异地就医登记备案并获审核后,就能使用本地医保卡在沪苏浙皖任何一个地级市符合条件的定点医院享受门诊直接结算。目前长三角异地就医门诊费用直接结算运行情况总体良好,截至9月15日,长三角门诊直接结算总量累计达26.4万人次,涉及医疗总费用5900余万元。
3.山东启动DRG付费省级试点工作。山东省医保局在济南召开按疾病诊断相关分组(DRG)付费省级试点工作启动会。据悉,首批选取省本级和济南、枣庄、东营、烟台、潍坊、威海、日照、临沂、聊城、菏泽10个市开展DRG付费省级试点。DRG付费是一种医保基金为患者购买诊疗服务的支付方式,按照同病、同治、同质、同价的原则,根据患者的临床诊断、年龄、合并症、并发症等因素,将治疗疾病所产生的医疗费用相近的患者划分到相同的诊断组进行管理。
股市资讯
.
审评动向
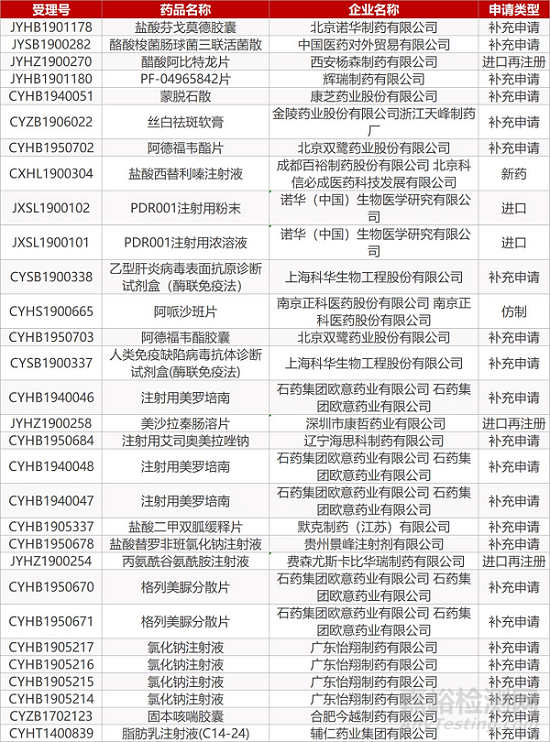
1. CDE最新受理情况(09月29日)
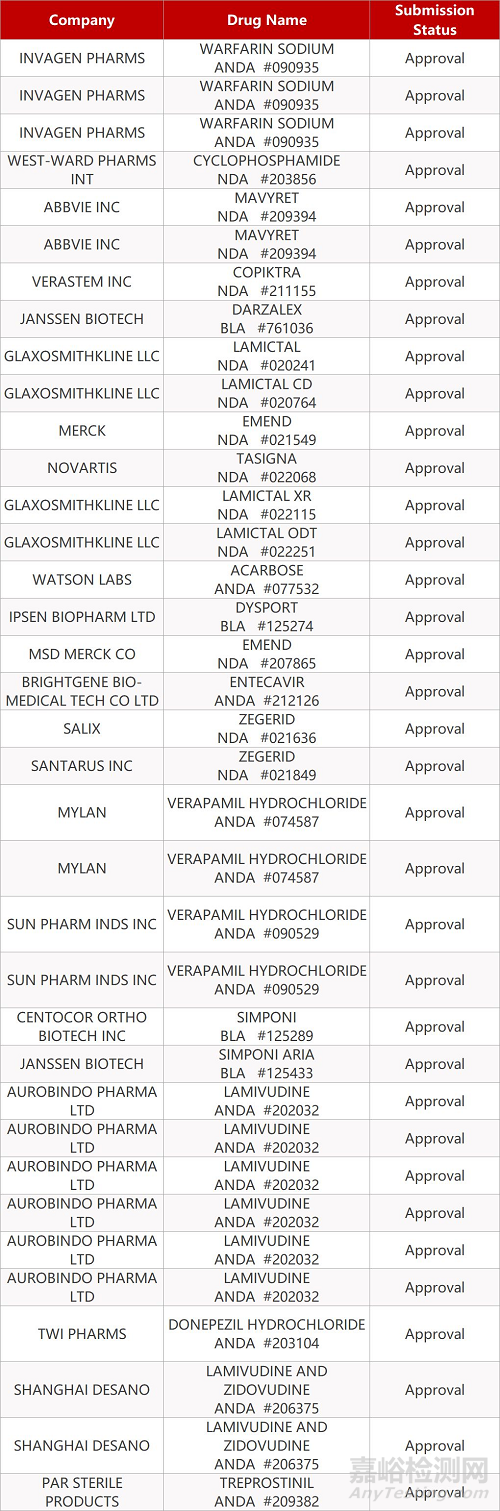
2. FDA最新获批情况(北美09月28日)

来源:药研发


