您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-11 09:06
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
默沙东公布KEYNOTE-042研究中国数据。默沙东(MSD)重磅抗PD-1疗法帕博利珠单抗(Keytruda)公布Ⅲ期KEYNOTE-042中国研究的积极数据。该研究旨在比较Keytruda单药与标准铂类化疗治疗局部晚期或转移PD-L1阳性(肿瘤比例评分TPS≥1%)非小细胞肺癌患者的疗效。结果显示,对于PD-L1 TPS≥50%、≥20%和≥1%的患者,Keytruda与化疗相比均改善患者OS;在TPS为1%-49%的患者中,Keytruda对总生存期的改善同样优于化疗(19.9 vs 10.7);3~5级药物相关的不良事件发生率Keytruda组为17%,化疗组为68%。结果表明,与一线治疗相比,Keytruda单药可改善患者OS,且具有良好的安全性,中国研究数据与全球研究的主要终点一致。
国内药讯
1.易明医药多潘立酮片首家通过一致性评价。易明医药全资子公司维奥制药多潘立酮片首家通过该品种仿制药一致性评价。多潘立酮片是一种多巴胺受体拮抗剂,被广泛用于治疗恶心和呕吐。该药原研药由杨森研发,最早于1980年在法国获批上市。1989年该品的原研地产化产品(西安杨森生产)在中国获批上市,规格为10mg,商品名为吗丁啉。该品种为国家基药目录(2018年版)胃肠解痉药及胃动力药。目前国内有22家企业获得该药品批准文号。2017年度国内多潘立酮片的销售额近12亿元。
2.复星医药苯磺酸氨氯地平片通过一致性评价。复星医药旗下苯磺酸氨氯地平片获国家药监局核发的《药品补充申请批件》,该药品通过仿制药一致性评价。苯磺酸氨氯地平片主要用于高血压、冠心病的治疗。截至目前,于中国境内已获批上市的苯磺酸氨氯地平片主要包括辉瑞制药的络活喜、华润赛科药业的压氏达等。根据IQVIA CHPA最新数据,2018年度苯磺酸氨氯地平片的国内销售额约为人民币 27.5 亿元。
3.康朴生物I类创新药KPG-818在美获批临床。康朴生物CRBN E3泛素连接酶复合物(CRL4-CRBN)调节剂KPG-818获FDA批准,即将在美国开展用于治疗多种血液肿瘤(包括套细胞淋巴瘤、成人T-细胞白血病-淋巴瘤、惰性淋巴瘤、滤泡型淋巴瘤、弥漫大B细胞淋巴瘤、多发性骨髓瘤等)的临床试验。KPG-818在临床前试验中展现了良好的GLP毒理耐受性以及药代动力学成药特点,并在多种血液肿瘤动物模型上显示了良好的治疗效果。此外,KPG-818在美国即将完成的用于治疗系统性红斑狼疮的I期临床中也显示出良好的口服吸收、药代动力学参数及毒理耐受等特点。
4.恒瑞医药PD-L1单抗联合疗法获批临床。恒瑞医药自主研发的PD-L1单抗SHR-1316和另一款单抗SHR-1704联合用药的临床申请获国家药监局批准。据悉,SHR-1316单抗可以解除PD-L1介导的免疫抑制效应,增强杀伤性T细胞的功能,发挥调动机体免疫系统清除体内肿瘤细胞的作用。全球已有多款PD-L1抗体药物获批上市(如罗氏重磅新药atezolizumab等),而国内尚无PD-L1获批上市。目前SHR-1316正在开展的3项临床研究,其适应症分别为小细胞肺癌、广泛期小细胞肺癌及晚期恶性肿瘤。SHR-1704是一种人源化单克隆抗体,目前全球也尚无该品种同类产品获批。此次SHR-1704获批临床,包括单药或与SHR-1316的联合用药。
5.步长制药1类新药WXSH0024胶囊获批临床。山东步长控股子公司丹红制药在研药WXSH0024胶囊获国家药监局临床试验默示许可。WXSH0024是丹红制药与药明康德联合研发的AT2R 拮抗剂,临床拟用于神经病理性疼痛的治疗。注册分类为化学药品1类,即“通过合成或者半合成的方法制得的原料药及其制剂”且“尚未在国内外上市销售”的制剂。
6.万泰生物与GSK将联合开发新一代宫颈癌疫苗。厦门万泰与GSK签署一项全球合作协议,双方将基于源于厦门大学的创新抗原技术与GSK的佐剂系统联合研发新一代的人乳头瘤病毒(HPV)疫苗。据悉,厦门万泰将在厦门海沧建设疫苗生产线,并将生产出的多个型别HPV疫苗抗原提供给GSK,由GSK将这些抗原和葛兰素史克的专利AS04佐剂结合,以研发新的HPV疫苗并在包括欧美在内的全球范围内实现商业化,厦门万泰还将获得该新疫苗在中国及部分其他国家的独家经销权。目前市面上仅有默沙东和GSK的宫颈癌疫苗获批上市。
国际药讯
1.艾尔建眼科新药申请上市。艾尔建与Molecular 公司联合开发的血管内皮生长因子A(VEGF-A)拮抗剂abicipar pegol治疗新生血管(湿性)年龄相关性黄斑变性(nAMD)的新药申请(NDA)获FDA受理,预计在2020年年中获得审查结果。此外,该药的营销授权申请(MAA)也已获欧洲药管局受理,预计在2020年下半年获得审查结果。BLA和MAA基于2项头对头III期临床研究(SEQUOIA,CEDAR)的数据,该结果支持了abicipar每季度一次给药方案与罗氏/诺华Lucentis(ranibizumab,雷尼珠单抗)每月一次方案相比在第一年注射次数减少50%以上(6次 vs 13次)的情况下维持视力的非劣性疗效。
2.阿斯利康PD-L1组合疗法治疗ES-SCLC结果积极。阿斯利康在WCLC 2019会议上公布PD-L1单抗Imfinzi(durvalumab)与化疗联用一线治疗广泛期小细胞肺癌(ES-SCLC)的Ⅲ期CASPIAN研究积极的详细结果。结果显示,与标准化疗相比,Imfinzi组合疗法将患者的死亡风险降低27%。Imfinzi组合疗法组中位总生存期为13.0个月,对照组为10.3个月。约有33.9%的患者在接受Imfinzi组合疗法后,生存期超过18个月,而对照组为24.7%。Imfinzi组合疗法在其它疗效终点上也表现出益处:12个月无进展生存率为17.5%,对照组为4.7%;患者的总缓解率达到67.9%,对照组为57.6%等。此外,Imfinzi组合疗法的安全性与前期试验一致,没有发现新的安全性问题。
3.Acadia治疗痴呆症相关精神病的Ⅲ期研究结果积极。Acadia公司开发的选择性血清素受体反向激动剂pimavanserin Ⅲ期试验HARMONY达主要终点。该研究旨在验证pimavanserin在不同亚型的痴呆症相关精神病患者中缓解幻觉或妄想的有效性和安全性。试验中期有效性分析显示,与安慰剂相比,pimavanserin能显著延长患者痴呆症相关精神病再度复发前的缓解持续时间,达主要终点。基于这一结果Acadia公司提前终止该项试验。Pimavanserin 2016年已获FDA批准治疗帕金森病患者中的幻觉和妄想,Acadia计划于2020年为该药提交补充新药申请。
4.Biohaven公司口服CGRP受体抑制剂rimegepant Ⅲ期结果积极。Biohaven公司公布其口服CGRP受体抑制剂rimegepant在BHV-3000-201研究中的积极结果。1700多例至少有1年以上患偏头痛病史的成年患者参与该项研究,结果显示,rimegepant可使患者MIDAS(偏头痛残疾评定量表)指标较基线有明显改善,其致残率降低约41%;使MsQOL(偏头痛特定生活质量量表)指标较基线也都有明显的改善;在整个治疗随访期间,患者各项活动的出勤率均有显著提高。此外,rimegepant可将由偏头痛带来的生产力损失时间降低50%。Biohaven公司已在今年第二季度向FDA递交了该药的新药申请并使用了优先审评券。
5.Nkarta公司完成B轮融资。致力于研发NK细胞疗法的Nkarta公司完成B轮1.14亿美元的融资,用于推进该公司NK细胞疗法的临床研究,包括靶向NKG2D的同种异体NK细胞疗法NKX101,用于血液恶性肿瘤或实体肿瘤患者;以及其针对B细胞恶性肿瘤CD19的CAR-NK项目的IND授权和临床试验。Nkarta公司表示,使用NK细胞疗法可以消除现有CAR-T疗法治疗恶性血液肿瘤的限制,减少副作用,如由于CAR-T细胞过度激活免疫系统导致的细胞因子释放综合征。预计明年将会申请多个INDs用于治疗一系列血液癌症和实体肿瘤。
医药热点
1.国家癌症区域医疗中心标准发布。国家卫健委公布《国家癌症区域医疗中心设置标准》,并发布200多个病种的疑难危重症病种清单以及300多项技术的核心技术清单。《标准》明确要成为该中心应具备的6个要求:三级甲等肿瘤专科医院或具备相应肿瘤专科能力的三级甲等综合医院;近3年年均收治癌症患者≥5万人次,其中疑难危重病例数≥60%等;肿瘤放射治疗年总人次≥5000人次,直线加速器≥5台,并有后装近距离治疗设备;年均病理会诊量≥1.5万次;重症监护室床位数占医院床位总数≥1%;须获得肿瘤科国家临床重点专科建设项目。
2.深圳新政:新招全科医生每人补助2万元。近日,深圳卫生健康委发布《关于印发改革完善全科医生培养与使用激励机制若干措施的通知》,公布了一系列加强全科医生待遇保障的措施。《通知》表示,从2019年起,新招录的全科医生转岗培训人员培训合格,且在原注册执业范围基础上增加全科医学专业执业范围的,市财政按每人2万元标准进行补助。
3.卫健委为基层医疗学分减负。国家卫健委发布《关于落实为基层减负措施改进继续医学教育有关工作的通知》。《通知》明确提出要落实“放管服”改革,发挥远程继续医学教育作用。全国继续医学教育委员会通过办公室和全国继续医学教育管理平台集中向社会公开发布国家级远程继续医学教育项目,医务人员根据需求自主选择学习平台,所获学分在全国范围内适用,省域间互认,各地不得直接或变相设置区域准入条件。
【复星医药】控股子公司上海复星医药产业发展有限公司产品Tenapanor片用于便秘性肠易激综合症治疗的临床试验申请获国家药品监督管理局注册审评受理。
审评动向
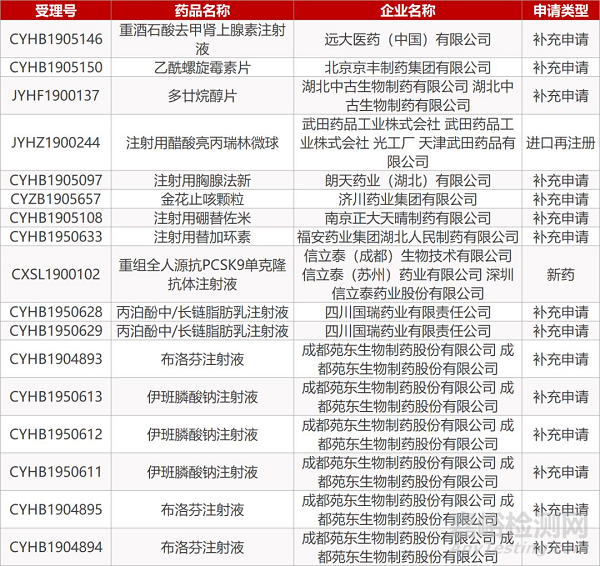
1. CDE最新受理情况(09月10日)
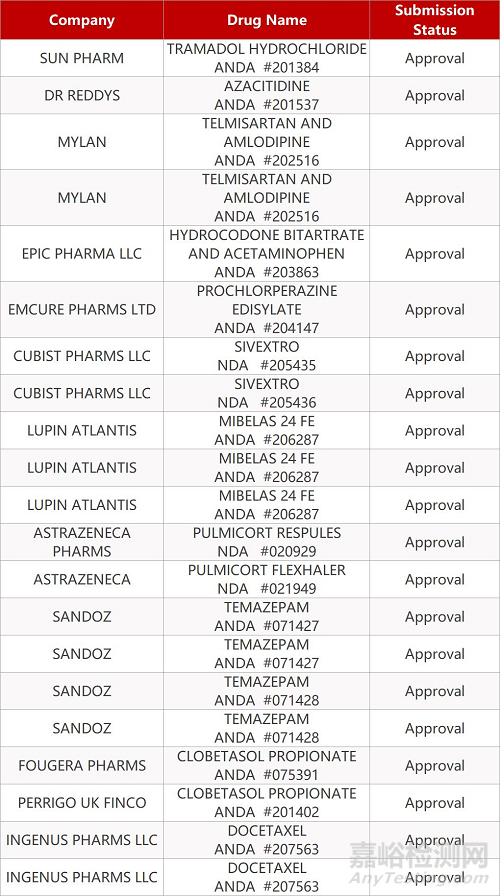
2. FDA最新获批情况(北美09月09日)

来源:药研发