您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-02 11:49
今天和大家讨论体外诊断试剂分析性能评估的内容,今天主要跟大家讨论如何定出体外诊断试剂的参考区间,参考区间主要是针对定量的体外诊断试剂而言的,参考区间评估的内容非常多,我们会分两节微课来和大家介绍。
今天是第一节,主要内容会会从四方面来展开:
重要的定义
评估参考区间的流程
选择参考个体
获得的参考个体样本分析前和分析时应考虑哪些因素
首先我们来看重要的定义,
参考个体(Reference individual):根据明确的标准选择出来进行测试的人
参考人群(Reference population): 由参考个体组成的一群人
参考样本组(Reference sample group):能够代表参考人群的足够数量的人
参考值(Reference value):通过观察或测量参考个体上特定类型数量获得的值(测试结果)
参考分布(Reference distribution): 参考值的分布
参考限(Reference limits): 从参考分布派生出来的值,是用于描述的目的的
参考区间(Reference intervals): 参考值上限和下限之间的范围
定义非常多,记起来也不容易,好在这些定义之间是有关联性的,请见下图:

参考个体组成了参考人群,从参考人群中选出参考样本组,对在参考样本组的人进行检测得出很多参考值,进而可以了解参考值的分布和参考限,最终定出参考区间。某一个病人的测试结果可以和参考区间做比较,了解这个人是否患病。
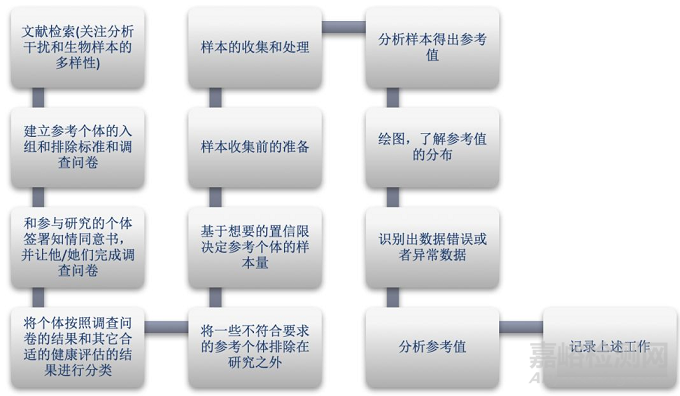
接下来我以全新分析物或全新分析方法为例,和大家介绍一下如何评估参考区间,具体的流程是这样的:
现在我们很清楚参考个体的选择是很重要的,那么如何做好这个工作呢?你可以通过定出明确的排除标准,分组标准和设计调查问卷的方式把这个工作尽量做好。
通常排除标准会包括:嗜酒,最近有献血,最近有服药,节食等等。一般会按照年龄,性别,种族等等来进行分组。调查问卷的作用是了解个体的具体信息,基于具体的信息做出入组还是排除的决定。
分析前主要要考虑的因素有:取样前每个个体的准备工作,样本的收集和处理。
在实际进行样本分析时也会出现一些影响分析结果的因素,主要要考虑:分析性能,仪器/设备,试剂,检验方法,结果计算方法,QC材料。
最后做一个总结,这堂微课主要和大家讨论了参考区间评估的重要定义和流程,定义很多大家可以借助一张图去了解之间的关系。流程有很多步,比较重要的是参考个体的入组,还有分析前和分析时要注意的问题。
大家好,今天我接着给大家上评估定量体外诊断试剂的参考区间的第二节微课,主要有四块内容:参考值的分析、参考区间的转移、参考区间的确认和参考区间的呈现。
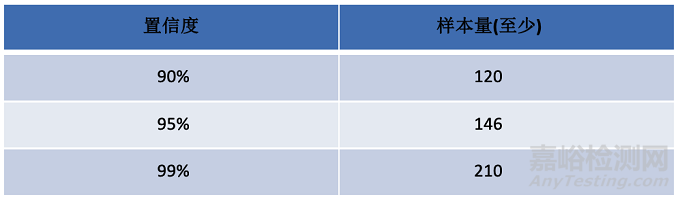
请注意表中的样本量指的是获得的有效参考值的数量,基于90%置信度的要求,你只选择120个参与测试,很可能得不到120个有效的参考值,在这种情况下你就要多招募一些人了。
既然有有效参考值,那么在实际的工作中就会出现离群值,离群值我们要怎么来处理呢?在标准中提到了两种方法:
D/R (D指的是极端值和最靠近极端值之间的差值,R指的是所有观察值的范围, 如果D/R≥ 1/3, 可以认为该值是离群值)
IQR(Interquartile range), 25thpercentile的值是Q1, 75thpercentile的值是Q3, IQR=Q3-Q1, 正常值的范围(Q1-1.5XIQR, Q3+1.5XIQR), 未落在正常值范围的是离群值。
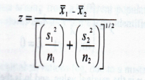
在上一堂参考区间的微课中有提到将参考样本进行分组,大家先想一下为什么要分组,分组的原因很简单,就是不同组(比如不同性别)之间的参考值差别太大,如果不分组制定参考区间,可能会造成后续诊断时出现假阳性或者假阴性的情况。因此如果不同组之间的参考值差别太大,就需要分组。那么要大到什么程度呢?标准中也给出了如下公式:
大于:
其中S1和S2 指的是标准差,n1和n2指的是不同组的样本量。如果Z>Z*,最好要进行分组。
从上述工作我们可以看到参考区间的评估涉及到的工作量是很大的,如果涉及到新的检测方法(同样的分析物),厂商或者实验室是否每次都要重新评估参考区间呢? 答案是否定的。那可以用什么方法呢?标准中有提到了参考区间的转移。
到底要如何转移呢?转移要基于两个基本条件:
分析系统的可比性
参考人群的可比性
首先我们来说说分析系统的可比性,假设分析系统是完全类似的(具备完全的可比性), 比如你之前开发的是Hb1Ac检测的试剂盒(有做完整的参考区间的评估), 现在开发了一款新的Hb1Ac检测的试剂盒,这两款试剂盒就具备完全的可比性。
另外在转移的时候你还要考虑参考人群的可比性,这个很容易理解,就是你的试剂盒测试的人群是不是类似的,如果不是类似的,就不具备参考区间转移的条件。
当然你不是做完转移就结束了,还应该要做一下参考区间的确认。就是看一下转移得到的参考区间是否真正准确。确认有三种方法:
主观评审
小样本的统计学测试(n=20)
大样本的统计学测试(n=60)
主观评审就是看之前参考区间的原始评估记录,看是否有未充分考虑的地方。这个方法还是会面临挑战的。我个人比较推荐用统计学测试的方法,就是选取一定的样本量进行评估,看评估出来的区间和转移的区间的吻合度(看差异有多大),样本量有大有小,小的话选择20个参考值就可以了,大的话要选择60个参考值。
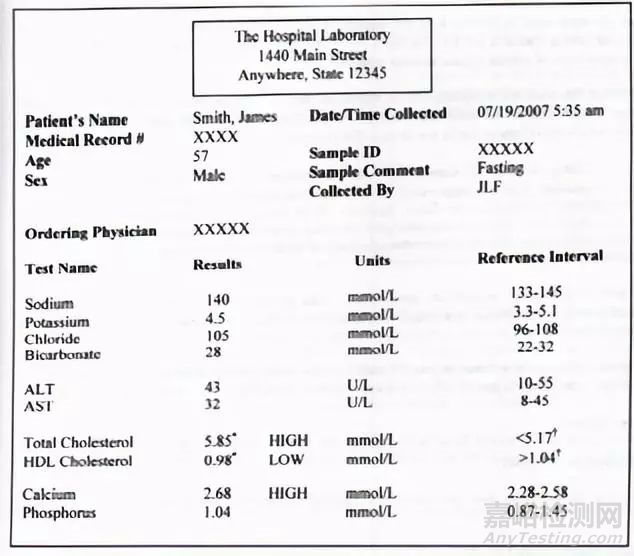
做了这么多工作,最后我们来看一下参考区间是以何种方式呈现的。在实验室层面,我们都有做过体检,也看到过自己的体检报告,体检报告会清楚地呈现参考区间的信息,让你一看就知道指标是否正常,标准中也给出了一个例子。
制造商层面在产品说明书中也要体现参考区间评估的详细的信息,包括选取的样本量,性别,年龄,人种,置信度和详细描述。关于详细描述,标准中也给出了一个例子:
用X试剂,Y标准,Z仪器进行评估,我们对120个年龄在20-30岁范围内的健康男性的A分析物进行了测试。按照Turkey方法(1977)没有发现离群值。运用非参数(不是正态分布)技术,去掉两个最高值和两个最低值。最后的参考区间是由剩下的95%的样本的测试结果得到的。
到这里,今天的微课介绍完了,结合上一堂微课一起做一个总结,这两堂微课主要和大家介绍了参考区间的一些重要定义,参考区间评估的流程,参考值如何分析,参考区间的转移,参考区间的确认和参考区间的呈现。
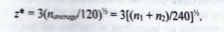


来源:启升资讯


