您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-26 10:23
摘 要 Abstract
自“一带一路”倡议实施以来,中药出口贸易额呈逐年上升趋势。现如今国际药品主流国家和地区包括美国、欧盟、加拿大、澳大利亚等均已将天然药品/ 植物药(含中药制剂)纳入非处方药管理。但因我国中药制剂现行标准无法在国际注册中与上述国家和地区药品监管完全对标,导致无法顺利完成注册。本文着重从中药制剂标准的监管角度,对比上述国家和地区对天然药品/ 植物药质量标准中农药残留、重金属及有害元素、黄曲霉毒素、微生物检验项目的规定,并从原料把关、检验检测方法学建立和制剂质量标准提升等方面提出建议。
Since the implementation of the Belt and Road Initiative, the export of traditional Chinese medicine (TCM) has been steadily increasing. Currently, major countries and regions in the international pharmaceutical market, including the United States, the European Union, Canada, and Australia, have incorporated botanicals/natural medicines (including TCM preparations) into the management of over-the-counter drugs. However, the current standards for TCM preparations in China do not align completely with the regulatory standards of these countries and regions, leading to challenges in completing international registrations. This article focuses on the regulation of standards for TCM preparations, comparing the regulatory requirements of the aforementioned countries and regions regarding pesticide residues, heavy metals and harmful elements,aflatoxins, and microbial limits. Suggestions are put forward for improving raw material control, establishing inspection and testing methodologies, and enhancing preparation quality standards.
关键词 Key words
中药制剂;国际注册;质量标准;强制检验
traditional Chinese medicine preparations; international registration; quality standards; compulsory inspection
为进一步推动我国中医药事业健康发展,国家出台了《中医药发展战略规划纲要(2016—2030 年)》, 提出“ 实施中医药海外发展工程,推动中医药技术、药物、标准和服务走出去”“鼓励中医药企业走出去,加快打造全产业链服务的跨国公司和知名国际品牌”[1]。2023 年,《国务院办公厅关于印发中医药振兴发展重大工程实施方案的通知》进一步提出“重点支持中医药产学研用开放发展”“中医药机构参与全球中医药各领域合作的平台更加多样,机制更加灵活,中医药海外认可度和接受度进一步提升”的发展目标[2]。在一系列国家层面利好政策的推动下,我国中药研发、生产企业都在努力加快中药制剂的国际化进程。
自1990 年起, 包含我国中药制剂在内的补充药品(complementary medicines)、 天然药品等植物药相继纳入澳大利亚、欧盟、加拿大[3] 等国家和地区的非处方药管理体系,这些国家和地区均出台了天然药品/ 植物药(含中药)监管法律法规、注册管理办法。在我国,中药制剂的质量标准通常以《中国药典》制剂通则及品种各论要求为依据。在国际注册中,中药制剂往往以国内现行标准应对国际技术审评,而忽略了国际上强制检验项目的建立。正是这些检验项目的缺失,放慢了国际化的步伐。因此,在中药制剂国际注册中,申报者应按照目的国家和地区的法规要求,及时建立强制检验项目的检验检测方法学。
1、 中药制剂国际化现状
1.1 中药制剂国际贸易现状
随着国际市场对天然药品接受程度的提高,我国中药出口额呈逐年上升趋势。出口的中药产品一般分为4 类:中药提取物, 中药材及饮片, 中药制剂, 保健食品。2022 年,我国中药出口额为56.9亿美元,同比增长13.8%[4]。2022 年我国4 类中药产品出口额比例如图1 所示,其中中药提取物占比近62%,中药制剂占比不足7%。
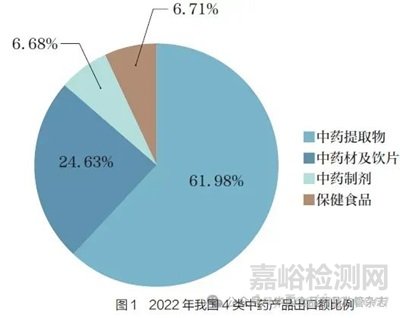
现阶段,我国对外出口的中药产品仍以低附加值的中药提取物、中药材及饮片等原料药为主[5],而具有较高附加值的中药制剂只有通过国际注册、认证等监管程序,才能进入国际药品市场进行销售。目前,我国中药制剂在质量标准、法规技术等方面与西方国家存在一定差异,加之各种壁垒如质量壁垒、技术壁垒、专利壁垒和绿色壁垒等,大大限制了中药的国际贸易,这对我国中药制剂国际化道路造成了极大阻碍[6]。
1.2 中药制剂现行标准难以对标国际审评
历经20 余年制剂生产质量监管法规体系建设和国际化发展,中药制剂在质量标准制定、有效成分和作用机制研究等方面已逐渐缩短与国际主流国家和地区的差距[7]。随着国际化的推进,中药因其天然来源、独特疗效等优点也逐渐被国际市场接受和认可。但中药制剂在进入国际药品市场时,其质量控制方面仍然存在一系列问题,这是阻碍我国中药顺利通过国际注册的关键所在[8]。
究其原因,我国中药制剂生产和管理依从《中国药典》、药品注册标准和其他药品标准。在国际注册过程中,以国内现行标准无法完全对标主流国家和地区药品监管的标准要求,难以顺利通过严格的技术审评。因此,为达到中药国际化总目标,提升中药质量已迫在眉睫。
2、 中药制剂国际注册中面临的挑战
我国在大力推进中药现代化的进程中,进一步加强了中药制剂的国际标准协调和研究。2020 年版《中国药典》加强了与主流国家和地区药典的对比研究,从国际成熟技术标准的借鉴和转化入手,不断推进与各国和地区药典标准的协调。从发展历史来看,2015 年版《中国药典》将液相色谱- 串联质谱法、分子生物学检测技术、高效液相色谱- 电感耦合等离子体质谱法等用于中药质量控制。2020 年版《中国药典》新增聚合酶链式反应法、DNA 测序技术等指导原则,进一步扩大了国际公认的成熟分析技术应用,为中药制剂标准提升提供了技术支撑[9]。但我国对重金属、黄曲霉毒素等外源性有害物质的控制标准的强制实施仅体现在原料药层面,难以满足中药制剂国际注册要求,具体体现在以下两个方面。
2.1 部分国际强制检验项目在我国尚未全面实施
美国、欧盟、加拿大、澳大利亚等主流国家和地区对天然药品/ 植物药质量标准中农药残留、重金属及有害元素、黄曲霉毒素等外源性污染物设置了相应的限度并实施强制检验,而我国中药制剂在注册申报中并未将此类检验设为强制检验项目。微生物限度方面,虽已作为《中国药典》制剂通则中的强制检验项目,但必检项和控制菌类别与国际存在差异。2020年版《中国药典》四部通则“1107 非无菌药品微生物限度标准”是基于药品的给药途径和对患者健康潜在的危险以及药品的特殊性而制定,并未涵盖全部中药制剂。例如,金黄色葡萄球菌在国际制剂注册中属必检项,但在我国中药制剂注册中并非全部要求。
上述检验项目虽已经在2020 年版《中国药典》四部通用技术要求中建立相应方法,但对于绝大多数中药制剂并非强制检验项目,制剂生产企业尚未建立国际注册所需的检验检测方法学和相应的日常检验检测记录。
2.2 抽检不达标项目集中
在我国中药制剂监管中,上述检验项目并非全面实施。在国家药品抽检中,中成药整体质量较好;多年来相关监管工作取得了显著效果,外源性有害残留整体风险可控[10]。在探索性研究中,不达标项目主要集中在重金属及有害元素、黄曲霉毒素、农药残留等外源性污染物方面。
中药制剂由于其复杂性以及当前中药/植物药国际监管差异,导致部分现有质量标准以外的潜在问题被忽略,但往往在国家抽检或国际注册过程中会暴露出来,因此中药制剂国际化品种筛选过程中应尤为注意,如生脉胶囊存在五氯硝基苯超标的情况[10],在开展国际化品种筛选时应着重考察并加以控制。
农药残留、重金属及有害元素:主要存在于中药材、中药饮片等原料药,而中药制剂除了探索性研究外尚未检索到更多公开数据。中药制剂中重金属及有害元素污染主要是由中药材种植过程中环境因素、不同部位对重金属种类的吸收和富集以及不当的炮制、加工、贮藏所导致[11-13]。农药的不当使用现象较为普遍,特别是在缺乏统一规范与集中管理的中药材种植区。
黄曲霉毒素:主要存在于根茎、果实类中药,制剂的生产加工、储存运输不当也会引起黄曲霉毒素污染[14-15]。刘蕊等[16] 对2015 年版《中国药典》规定的19 种中药材进行黄曲霉毒素检测,其中柏子仁检出率为100%,远志、地龙次之,2015 年版《中国药典》未作规定的茯苓等药材也有检出。
微生物:贯穿原料、辅料、包材、生产制备等中药制剂生产全过程[17]。微生物限度检测项目是中药制剂国际注册质量标准限制因素中,我国唯一全面实施的检查项。在国际注册实践过程中,也存在微生物污染问题。例如,在稳定性考察初期微生物限度符合要求,但在后期考察过程中微生物超标情况时有发生,在产品复检过程中尤为突出。
3、 国际注册质量标准差异对比及探讨
美国、欧盟、加拿大、澳大利亚等国家和地区自21 世纪初期均针对天然药品/植物药(含中药制剂)的监管设立了相应的政府职能部门,从国家法规层面进行了专门管理[8]。这些国家和地区的药品监管法规和质量技术要求均可从其药品政府职能部门进行检索:加拿大卫生部天然与非处方药品管理局、欧洲药品管理局草药产品委员会、澳大利亚药品管理局、美国食品药品监督管理局。虽不同国家和地区的市场准入要求在药品定位、分类依据、制剂类型等方面有很大差异,但都需要申请者提供该品种技术审查资料,监管部门对其安全性、有效性和质量可控性进行审查。
我国中药制剂与国际天然药品/ 植物药的质量标准差异主要表现在对农药残留、重金属及有害元素、黄曲霉毒素和微生物等外源性污染物的监管要求[18]。本文通过对比我国中药制剂与美国、欧盟、加拿大、澳大利亚等国家和地区天然药品/植物药的技术及监管要求,从农药残留、重金属及有害元素、黄曲霉毒素、微生物4 种强制检验项目的检测方法和限度等方面展开讨论,为中药制剂出口质量标准建立提供参考。
3.1 农药残留
针对天然药品/ 植物药制剂的农药残留检测项目,《美国药典》和《欧洲药典》限度要求相同,共规定了70 种农药残留限度;加拿大对天然药品农药残留的容差限度要求参照《美国药典》的规定执行;澳大利亚补充药品则参照《英国药典》的规定执行。目前我国仅针对饮片和中药材提出了农药残留检测要求,2020 年版《中国药典》“0212 药材和饮片检定通则”中规定了33 种不得检出的农药,此外,五氯硝基苯、六氯苯、七氯、氯丹在部分药材中也有规定,共规定了37 种农药残留限度。
各国和地区天然药品/ 植物药农药残留的检测方法见表1。我国引用了3 种检测方法,综合使用了多种色谱技术手段;美国和澳大利亚仅规定了气相色谱法;加拿大则参照《美国药典》等法规执行。

我国虽然制定了农药残留检测通用技术要求,但并未强制要求中药制剂进行农药残留检测。而在国际注册中,农药残留为强制检验项目,如加拿大在天然药品制剂审评中着重说明农药残留为必检项。因此,中药制剂在国际注册中需重点考查农药残留项目和限度要求。
3.2 重金属及有害元素
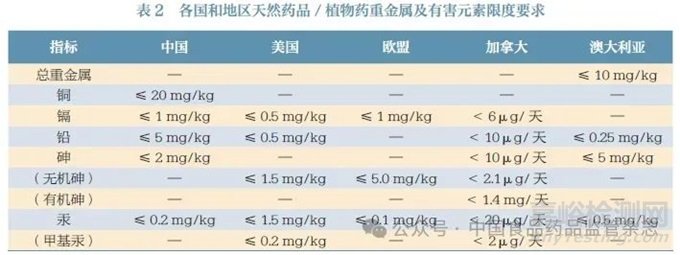
各国和地区天然药品/ 植物药重金属及有害元素的限度要求见表2。限度制定方面,加拿大按照天然药品的每日摄入量来制定限度,因此中药制剂在加拿大注册时应充分考虑每日服用剂量的换算。检测种类方面,我国增加了铜的测定,对甲基汞未做特别要求,砷含量测定未区分有机砷和无机砷。因此,在国际注册中还需建立和完善中药制剂的重金属及有害元素质量标准,并注意甲基汞、有机砷和无机砷等含量是否超标。
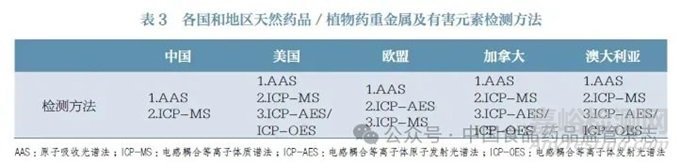
各国和地区天然药品/ 植物药重金属及有害元素的检测方法见表3。原子吸收光谱法(AAS)、电感耦合等离子体质谱法(ICP-MS)同时适用于中国、美国、欧盟、加拿大、澳大利亚的法定检测。因此,在国际注册中,依据《中国药典》建立的中药制剂检验检测方法学可满足美国、欧盟、加拿大、澳大利亚的注册要求,但是应注意各药典规定的检测标准品是否一致。
在美国、欧盟、加拿大、澳大利亚,重金属及有害元素属于强制检验项目,在注册中必须提供符合技术及限度要求的技术管理文件和检测合格报告。我国虽然制定了相应的技术通则,但尚未强制要求中药制剂进行重金属及有害元素检测。因此,申报者在中药制剂国际注册中需建立重金属及有害元素检验检测方法学并实施检测。
3.3 黄曲霉毒素
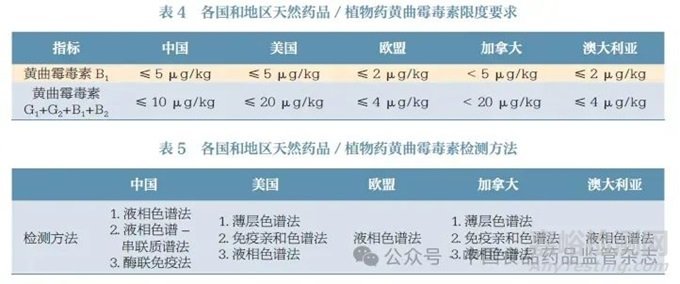
各国和地区天然药品/ 植物药黄曲霉毒素的限度要求和检测方法分别见表4和表5。限度要求方面,我国对黄曲霉毒素B1 的限度要求与美国和加拿大一致,对黄曲霉毒素G1+G2+B1+B2 的限度要求严于美国和加拿大,但均宽于欧盟和澳大利亚。检测方法方面,我国目前采用的黄曲霉毒素检测方法有液相色谱法、液相色谱- 串联质谱法和酶联免疫法,而欧盟和澳大利亚仅限于液相色谱法。目前,我国尚未强制要求中药制剂进行黄曲霉毒素检测,在国际注册中需建立黄曲霉毒素检验检测方法学并实施检测。
3.4 微生物
限度要求方面,我国对不同类型的中药制剂制定了较为完备的微生物限度要求,在2020 年版《中国药典》四部通则“1107 非无菌药品微生物限度标准”规定,非无菌含药材原粉且不含豆豉、神曲等发酵原粉的固体口服给药制剂需氧菌总数的要求是不得超过104cfu/g(或cfu/ml、cfu/10cm2),《美国药典》对固体口服制剂的要求是不得超过103cfu/g(或cfu/ml)。检测种类方面,我国主要是以不同给药途径加以限定,加拿大要求金黄色葡萄球菌是天然药品审评中的必检项。由于不同国家和地区对微生物的监管及限度要求存在差异,这对中药制剂的国际注册进程造成一定阻碍。因此,应及时根据出口国的法规、技术要求制定合适的检验项目和限度,以加快审评速度。
与国际主流国家和地区天然药品/ 植物药相比,我国中药制剂虽然在检测技术和限度要求方面建立了相关规范,但未对质量标准中农药残留、重金属及有害元素、黄曲霉毒素等外源性污染物的检测作强制要求,影响了中药制剂国际化步伐。
4、 中药制剂国际注册质量标准提升建议
中药制剂的质量可控是能够顺利通过国际主流国家和地区药品技术审评的重中之重。为早日实现中药国际化这一战略目标,我国中药制剂在国际注册中应从自身的质量控制入手,建立健全质量控制技术体系,结合国际天然药品/ 植物药质量标准要求开展标准提升工作。为满足国际药品监管要求,笔者提出以下中药制剂国际注册实施建议。
4.1 严把原料关
建议中药制剂生产企业选择质量相对稳定的药材来源,从具有《中药材生产质量管理规范》(GAP)资质方获取原料。国家层面,建议在现有基础上进一步扩大对药材的种植、加工和流通的监管,实行统一、科学、规范化监管,消除中药国际化不合规隐患。
4.2 依规建立国际强制检验项目检验检测方法学
中药制剂生产企业在建立国际注册质量标准时,不仅应关注国内现有法规质量指标,还应以国内现行通用技术指导原则为基础,结合国际监管要求,及时建立强制检验项目对应的检验检测方法学,以达到目的国家和地区监管部门对此类检验项目的技术要求,并形成实施记录文件以反映申报品种质量安全可控。
4.3 加强中药制剂质量标准提升研发
针对具有国际化发展潜力的优势中药品种,建议生产研发主体在满足国内监管的基础上及时把握国际天然药品/ 植物药监管及技术进展,加强质量标准提升研究,尽早建立并实施国际注册强制检验项目的检验检测方法学。有条件的中药制剂生产企业可以利用前沿检验检测技术,针对具有代表性的示范品种,开展如“中药制剂农药残留高通量筛选”等研究,将新技术、新成果用于国际注册申报中,积极应对国际注册审评。中药制剂在完成标准提升研究后开展国际注册工作,不仅可以避免在注册过程中重新建立新的生产和检验检测系统,有效减轻国际注册成本,还可以加快技术审评的进度。
5、 结语
中药的国际化发展稳步推进,会逐渐形成庞大的国际化产业集群。中药制剂通过国际注册,将品种的现行企业标准提升为国际标准。企业在完成与主流国家和地区天然药品/ 植物药质量标准对标过程中,向注册目的国家和地区提交注册申请材料,最终通过国际监管部门的技术审评。中药制剂完成国际标准提升工作,能够为中药标准国际互认奠定基础,进一步以点带面地从国家的“推荐实施”向“全面实施”推进,最终推动中药标准与国际接轨,建立国际互认机制,促进我国中药质量标准整体提升。
完善中药制剂质量标准建设是冲破国际注册技术壁垒的重要一环。如何更好地推动中药制剂达到国际天然药品/ 植物药质量管理水平、满足中药制剂国际上市要求,不仅需要生产企业自身的努力,更需要我国药品监管部门、科研机构和生产企业紧密结合尽早搭建专管共用的中药国际注册服务平台,加大海外中心建设力度,加强国家政府引导和组织,使更多优质中药品种按国际规则取得正式身份进入国际药品市场。

来源:中国食品药品监管杂志


