摘要:目的针对目前在制定污染控制策略时所存在的监测方式的有效性如何风险评估、污染控制策略如何与现有质量体系协同作用等难点,帮助人员理解污染控制策略的理念,更加有效地建立和实施污染控制策略。方法梳理污染控制策略的控制要素。从厂房设施、公用设备、原料控制、人员管理、清洁消毒等方面进行要点拆分,在整个工厂制定和实施一份记录在案的污染控制策略,并分析实施CCS过程的遇到的挑战和建议。结论对无菌药品CCS撰写要点的分析可为进一步加强无菌药品污染控制提供参考,不断降低药品污染风险,持续保证药品质量,同时也可以为无菌药品检查工作提供借鉴意义。
为最大程度降低药品生产过程中引入污染的风险,保证药品质量和患者用药安全,药品生产企业需要根据GMP的要求制定各种污染控制措施,但一直以来,这些污染控制措施相对独立,并未考虑各要素间相互作用和相互依存的关系。为进一步提高污染控制的有效性,欧盟GMP附录1(2022版)提出应在药品生产过程中采用整体控制的方式实施污染控制策略(CCS),通过确定包括厂房设施、设备、人员、公用系统、物料、产品和工艺、环境监测等在内的所有关键控制点,全面评估企业所有的污染控制和监测措施的有效性,来管控药品质量和用药安全性风险。针对目前在制定污染控制策略时所存在的监测方式的有效性如何风险评估、污染控制策略如何与现有质量体系协同作用等难点,帮助人员理解污染控制策略的理念,更加有效地建立和实施污染控制策略。
1.污染控制策略的制定
污染控制策略是基于对产品和工艺的理解而建立的一套针对微生物、热原/内毒素和微粒的计划性控制措施,源于对现有产品和工艺的理解并确保工艺性能和产品质量。控制措施包括原料药和制剂、组件相关的参数和属性、厂房设备设施操作条件、中间过程控制、成品质量标准以及相关方法和监控频次。它综合反映了 ICH Q8、Q9、Q10 的理念和要求,无论是针对新建厂房还是现有厂房,其制定依赖于详细的技术和工艺知识,需从整体的角度出发,融入风险管理意识,考虑污染防控的所有方面,涵盖厂房设施、设备、人员、公用系统、物料、产品和工艺、环境监测等与生产过程密切相关的所有要素,并建立各要素内部以及各要素之间的相互联系,实现全面且主动的污染控制。对于有多条生产线和多品种产品的情况,可以按产品分别书写污染控制策略文件,也可以在生产线进行划分,相同的生产线上的产品书写一份CCS文件,以实现体系化管理。所有的污染控制策略文件进行目录索引,以便快速找到对应生产线或产品的污染控制策略。
2.污染控制策略的控制要素
2.1 CCS风险评估
欧盟《GMP附录l:无菌药品的生产》指南中提到,CCS需考虑的要素包括但不限于:厂房和工艺的设计、厂房设施和设备、人员、公用系统、起始物料(包括中间产品)的控制、产品包装、供应商的批准(例如关键组分的供应商、组件的灭菌及一次性使用系统和服务)、外包服务、工艺风险评估、工艺验证、预防性维护保养(设备、公用系统及设施的计划性及非计划性维护保养)、清洁和消毒、监测系统和预防措施(趋势分析、调查、纠正和预防措施)。
无菌注射液和冻干粉针剂作为无菌药品的常用剂型,采用非最终灭菌的无菌生产工艺,生产过程存在多因素的影响,属于高风险剂型。因此,利用CCS理念,采用风险管理原则对人员、物料、环境、设施设备、生产工艺、验证清洁和消毒等生产各环节进行风险评估,进一步识别并制定无菌药品生产过程的污染控制点。对产品和工艺进行了相关关键质量属性、关键工艺参数、关键物料属性、工艺设计风险分析,通过评估设施和制造过程的每个步骤并记录结果。对设备和设备设施通过验证主计划的制定和追踪,定期通过再确认和持续确认以及预防性维护保障设备设施来评估保障设备良好的运行状态。原材料和包装得到充分控制并进行检测,确保微生物限度、内毒素满足使用要求。根据供应商的风险水平来确定适当的质量监督(供应商审计、质量协议、周期性评估频率等)以确保使用物料的质量发生污染控制问题时有备选供应商或同供应商进行沟通,解决遇到的问题与挑战。
2.2 CCS控制撰写要点梳理
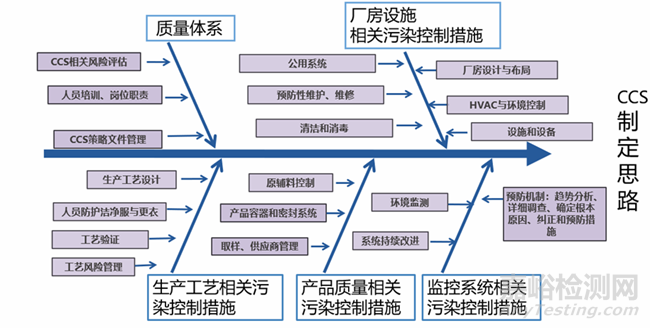
在无菌产品生产过程中,所有步骤必须按照适当的污染控制策略(CCS)完成,以防止产品污染。通过一套有计划的控制来实现,源于对当前产品和工艺的理解,以确保产品工艺性能和产品质量。CCS的制定思路详见图1所示。(1)首先CCS考虑的是通过良好的设计来实现控制。例如厂房设施设计、工艺设计等可实现该策略。(2)其次,为尽量减少微生物和微粒污染以及化学交差污染而采取的控制和步骤是一系列相互关联的措施,通常对这些措施进行评估,包含诸如厂房设施、公用设备、原料控制、人员管理、清洁消毒等。(3)再次,为了控制可能对产品质量产生不利影响的潜在污染,并评估所采用的所有控制和监测措施的有效性,必须在整个工厂制定和实施一份记录在案的污染控制策略,必要时应采取纠正和预防措施。
图1 CCS制定总体思路设计





2.4微生物污染控制策略有效性分析
通过总结污染控制策略的有效性分析结果,确定CCS报告是否需要更新。同时通过变更控制、上一年度验证的回顾、关键工艺参数的回顾、质量趋势回顾、污染事件、环境监测、无菌工艺模拟试验报告的情况来观察是否有CCS的不良趋势并确定这些不良趋势是否对CCS报告有一定的影响。
3.CCS遇到的挑战和建议
3.1洁净服的管理:
洁净服材质应为100%化纤无纺布,无纤维脱落,并经防静电处理。洁净区的洁净服,应首先考虑对环境无害,对人体无害,无过敏,穿着舒适,不影响操作。对洗涤、消毒处理及高压蒸汽灭菌有耐久性,不易磨损、便于整理。洁净服的接缝处应光滑,无口袋,袖口、裤脚处收紧。洁净服的采购、清洁、灭菌、使用,应有完善的管理规程。通过不同区域使用不同颜色或不同样式的洁净服来防止人员的混淆。洁净服的清洗、消毒、灭菌次数,要经过验证。验证应包括洁净服的粒子发出量和粒子通透量。洁净服的供应商往往会有这方面的数据。但如果要求洁净服在现场使用情况下的验证数据很容易被忽视。例如,洁净服供应商的数据支持粒子发出量和粒子通透量,在50℃温度下清洗100次合格。但现场清洗洁净服的温度可能是65℃,那么厂家应该证明在65℃洗涤情况下,洁净服仍能忍受清洗100次循环。需要在现场使用情况下(包括洗涤、灭菌温度,时间长度,洗涤剂的使用等)进行验证。验证过的参数须在洁净服清洗消毒SOP里体现并有记录。
在人员洁净服的实际污染控制策略中考虑的污染控制元素和控制措施梳理如下:
3.2设备与组件管理
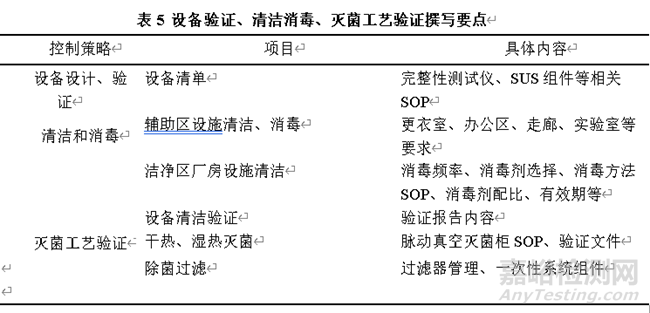
无菌药品生产设备、制药用水系统、纯蒸气系统、压缩空气系统、氮气系统和与药品直接接触的关键组件及密封件在设备使用过程中应做好监测、清洁、消毒、灭菌、维护与维修,按要求完成清洁、消毒及灭菌验证。关键组件及密封件的清洁灭菌方式、贮存方法、最长贮存期限、允许使用次数应经过验证。对于污染有直接影响的生产设备部件需要基于风险加强监测、提高更换频次,例如隧道烘箱中的高效过滤器、湿热灭菌柜中的空气滤芯、反应罐上呼吸阀、隔离器的操作手套等。根据生产设备情况选择适宜的清洁剂与消毒剂,开展消毒剂效力验证,基于验证结果制定科学的消毒方法。对于关键部件(如一次性系统、滤芯等)需加强供应商的管理,并建立适宜的质量确认要求(涉及安全性、产品相容性等),结合一次性使用系统的特殊性评估其污染的风险。
3.3环境菌库建设:
应正确评估微生物污染,不仅关注微生物数量和种类,更应关注微生物污染检出的频率,通常在一个采样周期内同一环境中多点发现微生物污染,可能预示着风险增加,应仔细评估。建议对受控环境收集的微生物进行适当水平的鉴定,微生物菌群信息有助于预期常见菌群,并有助于评估清洁或消毒规程、方法、清洁剂或消毒剂及微生物监测方法的有效性。尤其当超过监测限度时,微生物鉴定信息有助于污染源的调查,关键区域分离到的菌落应优先于非关键区域进行鉴定。实际工作中无菌试验阳性结果中分离出的微生物,经对其溯源分析,确认污染归因于无菌试验过程中所使用的材料或无菌技术的差错,该试验可判无效,否则判该产品不符合要求。对洁净室和其他受控环境分离到的微生物进行适当的鉴定,掌握环境微生物污染情况,有助于污染调查。为了确证微生物为同种中的两个相同株,需比对更多的基因序列和特征基因片段,甚至是全基因组序列的比对,实现既鉴定又溯源的目的,同时保证结果的准确性。微生物鉴定结果可以提供一些调查方向,如霉菌、芽孢杆菌等微生物往往与土壤、空气尘埃相关,假单胞菌、罗尔斯通氏菌等革兰氏阴性杆菌通常与积水相关,葡萄球菌等革兰氏阳性球菌说明污染很有可能来自于人员。尽管微生物偏差调查的难度较高,但可以通过有经验的微生物专家和调查团队一起强有力的及时行动和数据来确定最可能的根本原因。
4.结语
CCS是一份对当前的污染控制策略相关所有文档的汇总,包括但不限于管理文件、操作文件、风险评估文件、确认与验证文件、计算机化系统备份数据、人员培训档案、质量保证文件、生产检验仓储文件、其他纸质记录与数据汇总。明确所有的关键控制点和控制措施,避免产品的污染。无菌药品的污染控制不能仅依靠某一项控制措施,其取决于系统性的CCS。本文在对无菌药品CCS生命周期管理涉及的文件要求进行分析的基础上,对主要污染控制措施方面撰写要点,以及对的挑战和建议方面总结提炼,可为进一步加强无菌药品污染控制提供参考,不断降低药品污染风险,持续保证药品质量,同时也可以为无菌药品检查工作提供借鉴意义。
参考文献
[1] 王晓明. 制药工业微生物控制及无菌保障.
[2]国家药品监督管理局.《药品生产质量管理规范(2010年修订)》附录1:无菌药品[EB/OL].
[3]ICH Q10 药品质量体系、ICHQ12药品生命周期管理的技术和监管考虑。
[4]PDA TR90药品制造中的污染控制策略开发(2023)
[5]无菌药品生产污染控制策略技术指南(征求意见稿)(2023)