前言:早些时日,恰逢一个固体片剂品种(湿法制粒工艺)的中试放大生产,在下班后的“围炉夜话”上,几位制剂同仁对“粘合剂配制完毕后是否需要考察其存放时限”的问题展开了讨论。一种观点认为:在大多数情况下,粘合剂配制完成后即会加入至湿法制粒机中进行后序的制粒工艺,期间不会耽搁较多时间,增加其存放时限考察只是徒增工作量罢了;而另一种观点则恰恰相反,认为考察粘合剂存放时限实有必要。我们无法避免生产期间突发情况的发生,而一旦期间耽搁了较长时间后,粘合剂浆液的性质是否发生了变化、是否还能继续使用都是需要进一步确认的,主观上的决定弃留是对物料的浪费和对产品质量的不负责……
尽管目前CDE并未发布关于对中间产品/待包装产品存放时限针对性的指导原则,但随着ICH相关指导原则在我国的逐步实施以及国际通用的研发控制理念的逐步推行,我们亦可从国外各监管机构所出台的相关文件指南中窥知一二:
1、中间产品及待包装产品应在到达下一步生产工序前保持其质量属性不变,以避免对终产品产生不利影响;
2、生产过程中的每一种中间产品都应制定贮存时限。贮存时限同包装形式、贮存条件等密切相关,贮存时限应根据验证结果确定,并采取有效的管理措施在日常生产过程中进行控制,避免超出贮存时限;
3、任何延长储存或生产时间的情况均应符合GMP要求,如果过程中涉及到产品的运输和场地转移,还应考虑到运输期间的持续时间和条件是否与设定的贮存条件偏离太多,或由此带来的影响;
4、存放时限通常应在产品上市前确定,可使用中试或工艺验证期间的1个批次来验证。在涉及某些特殊产品提交上市许可申请时,须特别重视对其独特的贮存方式/贮存时间进行研究,提交的材料应科学、全面、严谨、详实。
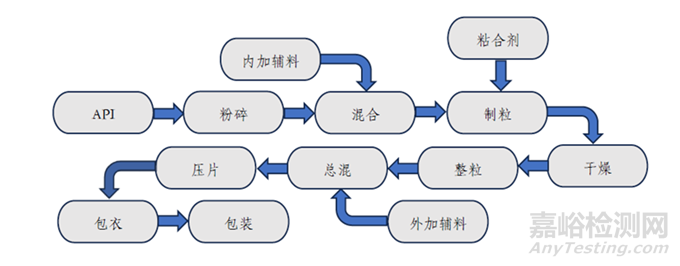
另外,QBD理念要求我们应将质控具体到生产过程中的每一阶段,以此来整体把握产品质量。WHO有文件以口服固体包衣片剂为例,提供了相关研究思路以供参考,如下:
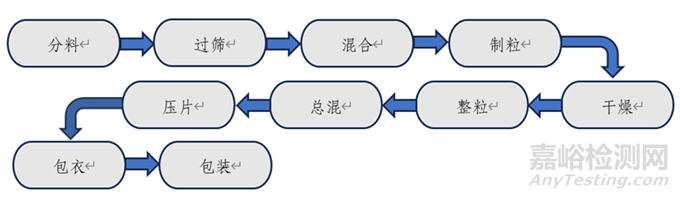
图1.普通口服固体包衣片剂一般工艺流程
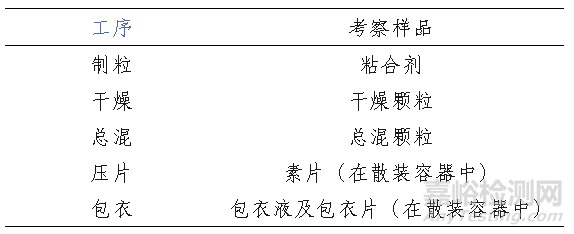
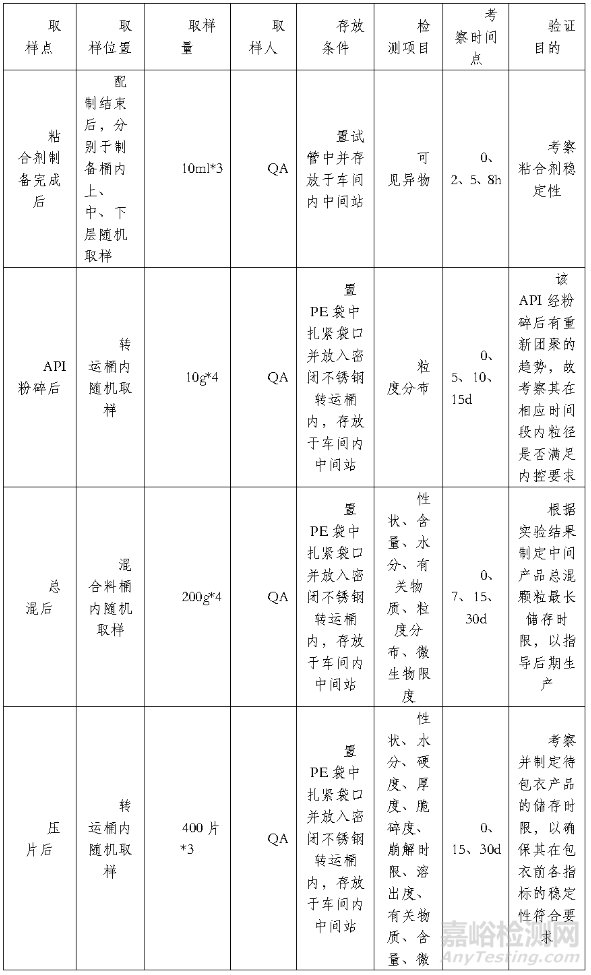
表1. 建议考察的工序及样品
表2. 检测项目及考察时间点
同样地,该研究思路可延伸至其他剂型,如液体制剂:
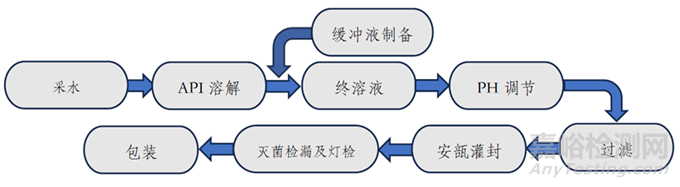
图2. 小容量注射剂一般工艺流程
表3. 建议考察的工序及样品
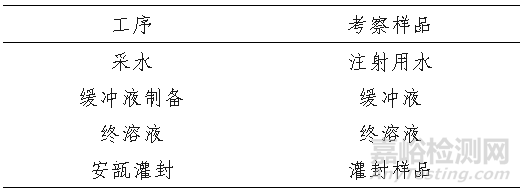
表4. 检测项目及考察时间点
注意:以上所列考察工序、项目、时间点等皆非强制性内容,研发人员可根据物料的状态和产品特性进行合理的设计。
在确定了存放时限考察的工序、检测项目、时间点后,我们应当对样品的取样、存放、检测给予必要的关注:
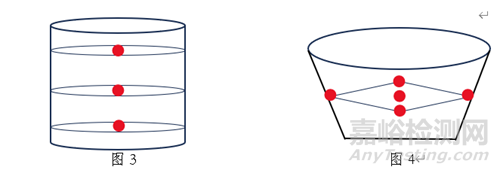
1.取样:以普通口服固体包衣片剂为例,其粘合剂样品可参考图3所示位置(红色圆点处)取样,干燥后颗粒样品可参考图4所示位置(红色圆点处)取样,素片样品可从压片全程中的前、中、后期及压片机的左、右站口分别取样等。总之,取样应以具体品种的特性为前提,并兼顾代表性、能真实反应样品的实际储存情况,同时取样量应满足考察的需求。
2.存放:样品存放的环境条件应与暂存区域或生产工序的条件相同。例如上述颗粒与素片可在其所在生产车间的中间站内进行存放考察,过程中所用的容器也应与生产过程中所用的包装相同或等效,同时要注意避免过度包装,如:整粒后的下步工序为总混,整粒后颗粒在转移过程中是置于双层聚乙烯袋中并放入不锈钢物料桶中遮光保存,那么在进行存放时限考察时也应采用相同条件进行考察。另外,如果考虑到实际生产过程中存在最差存放情况的可能,可用恒温恒湿箱来模拟最恶劣的储存条件,而对于易氧化产品,也应考虑到存放样品容器的顶部空间、体积大小对物料性质的影响。如果有任何过程中物料超过规定保存时间,应按照偏差管理的SOP进行处理,并按规范进行检验,之后才能放行至下一步。
3.检测:应对研究所用的分析方法进行全面的方法学验证,以保证其能完全满足样品的检测需求。如果数据显示在截至货架期的中间时间点有不利趋势或变化模式,则应考虑对同批成品进行长期稳定性测试。
笔者欲引一过往生产实例,以期增进对上诉理解:
图3. YYDS片生产工艺流程图
表5. YYDS片存放时限考察
参考文献
1.SOP for hold time study in pharmaceuticals
2.药品生产过程中中间产品/待包装产品存放时限的技术要求及审评考虑
3.Hold-time study for pharmaceutical tablet during manufacturing process:An innovative step
4.Standard practice of sampling, storage and holding time for pharmaceutical tablet and injection during manufacturing process
5.WHO:General guidance on hold-time studies