今日头条
苏庇罕见病新药获批上市。苏庇医药IL-1R拮抗剂阿那白滞素注射液获国家药监局批准新适应症,用于治疗斯蒂尔病(Still’s disease)。斯蒂尔病是一种病因不明的严重罕见炎症性疾病,包括成人斯蒂尔氏病(adult-onset Still’s disease,AOSD)和全身性幼年特发性关节炎(sJIA)。此前,该新药已获批治疗冷吡啉相关周期性综合征(CAPS)、家族性地中海热(FMF)。
国内药讯
1.基石PD-L1获批新适应症。基石药业PD-L1单抗舒格利单抗获国家药监局批准新适应症,联合化疗用于一线治疗表达PD-L1(CPS评分≥5)、局部晚期或转移性胃及胃食管结合部腺癌。在GEMSTONE-303研究中,与安慰剂联合化疗相比,舒格利单抗联合化疗明显改善无进展生存期(中位PFS:7.6个月vs6.1个月)和总生存期(OS:15.6个月vs12.6个月)。这是该新药在中国获批的第五项适应症。
2.传奇血液瘤CAR-T获推荐新适应症。传奇生物与强生开发的靶向BMCA的CAR-T疗法Carvykti(ciltacabtagene autoleucel,cilta-cel)获FDA肿瘤药物顾问委员会(ODAC)推荐批准,用于治疗至少接受过包括蛋白酶体抑制剂(PI)和免疫调节剂(IMiD)治疗、复发性或难治性多发性骨髓瘤(RRMM)成年患者。在III期CARTITUDE-4研究中,与标准治疗组相比,Carvyktii二线治疗显著性改善无进展生存期(HR=0.41,p<0.0001)。2022年,Carvykti已获批用于治疗至少曾接受4线以上前期治疗的RRMM患者。
3.AZ/第一三共ADC中国报产。第一三共与阿斯利康开发的Trop2-ADC新药Datopotamab Deruxtecan的上市申请获得NMPA受理。本月初,该新药已在欧盟提交两项上市申请,用于治疗局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)经治患者;以及用于转移性HR+、HER2低表达或阴性(IHC 0、IHC 1+或IHC 2+/ISH-)乳腺癌经治患者。该新药用于上述两项适应症的Ⅲ期研究(TROPION-Breast01和TROPION-Lung01)积极结果已在ESMO23大会公布。
4.先声再明妇科肿瘤抗体报产。先声药业旗下先声再明开发的新一代VEGF抗体注射用苏维西塔单抗的上市申请获NMPA受理,联合化疗治疗复发性卵巢癌、输卵管癌或原发性腹膜癌。该新药可选择性地与人VEGF结合并阻断其生物活性,减少肿瘤血管的生成并抑制肿瘤生长。今年年初,苏维西塔单抗已在Ⅲ期临床(SCORES研究)中达到主要终点,与化疗联用显著改善患者的无进展生存期(PFS)。
5.亦诺微溶瘤病毒获快速通道资格。亦诺微医药三合一溶瘤病毒产品MVR-T3011 IT(瘤内注射)获FDA授予快速通道资格,用于治疗既往铂类化疗和PD1/PDL1疗法失败的复发或转移性头颈部鳞状细胞癌(HNSCC)患者。MVR-T3011基于对I型疱疹病毒的全新设计,同时携带表达的两个外源性免疫调节基因PD-1抗体和IL-12,可促进肿瘤微环境的免疫反应。该疗法目前正在中美两国同步临床开发。
国际药讯
1.Mirum公司肝病小分子获批新适应症。Mirum公司口服回肠胆汁酸转运蛋白(IBAT)抑制剂maralixibat(商品名:Livmarl)获FDA批准补充新药申请(sNDA),用于治疗五岁及以上进行性家族性肝内胆汁淤积症(PFIC)患者的胆汁淤积性瘙痒症状。在Ⅲ期MARCH研究中,Livmarl治疗较安慰剂显著改善患者瘙痒程度(p<0.0001)。此前,FDA已批准Livmarl用于治疗1岁及以上Alagille综合征(ALGS)患者的胆汁淤积性瘙痒症。
2.BMS血癌CAR-T获批新适应症。百时美施贵宝CD19靶向CAR-T疗法Breyanzi(lisocabtagene maraleucel,liso-cel)获FDA加速批准新适应症,用于三线及以上治疗复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者。在I/II期临床TRANSCEND CLL 004中,liso-cel治疗的总体客观缓解率达到45%。今年1月,该新药的两项sBLA被FDA授予优先审评资格,用于治疗复发或难治性滤泡性淋巴瘤(FL)和套细胞淋巴瘤(MCL)经治患者。
3.FIC贫血新药获FDA推荐批准。Geron公司潜在“first-in-class”端粒酶抑制剂imetelstat获FDA肿瘤学药物咨询委员会(ODAC)推荐批准,用于治疗低风险骨髓增生异常综合症(MDS)的输血依赖性贫血成年患者。在Ⅲ期IMerge研究中,与安慰剂相比,imetelstat治疗第8周时显著提高不需要输血的患者比例(p<0.001);疗效持续接近一年。FDA预计在今年6月16日前作出最终审评结果。
4.默沙东K药宫颈癌Ⅲ期临床积极。默沙东PD-1抑制剂Keytruda联合放化疗(CRT)治疗新确诊高危局部晚期宫颈癌(IB2-IIB期淋巴结阳性、III-IVA期)患者的Ⅲ期KEYNOTE-A18临床达到主要终点。独立数据监测委员会评估,与安慰剂与CRT组合相比,Keytruda联合CRT显著改善患者的总生存期(OS)。该项试验此前已达到无进展生存期(PFS)主要终点,使疾病进展或死亡风险降低30%。此外,临床中没有发现新的安全信号。
5.Immuneering公司抗肿瘤新药早期临床积极。Immuneering公司第三代MEK抑制剂IMM-1-104治疗RAS突变、晚期实体瘤的Ⅰ/Ⅱa期临床结果积极。IMM-1-104可通过靶向MAPK通路中重要激酶MEK,以抑制MAPK通路的不正常激活。数据显示,IMM-1-104治疗有100%患者体内获得性RAS变异的产生受到抑制;超过一半的患者观察到目标病变消退。IMM-1-104总体耐受性良好,推荐Ⅱ期剂量(RP2D)为每日一次320mg。
6.阿斯利康收购罕见病药物公司。阿斯利康宣布已与Amolyt Pharma达成最终协议,将以最高10.5亿美元的总价收购Amolyt所有已发行股票,这包括8亿美元预付款以及2.5亿美元特定里程碑付款。Amolyt Pharma核心产品eneboparatide(AZP-3601)是一种治疗甲状旁腺功能减退的甲状旁腺激素(PTH)类似物,可通过结合PTH受体的R0构象,持续升高血钙。该新药目前已处于III期临床开发阶段。
医药热点
1.王宁利院士任河南省立眼科医院院长。3月14日,河南省立眼科医院院长聘任仪式举行,聘任国际眼科科学院院士王宁利为河南省立眼科医院院长。王宁利现年67岁,青海西宁人,长期致力于全球首位不可逆致盲眼病——青光眼的防治技术研究,是中国首位被世界青光眼联合会授予高级两栖临床科学家奖的中国学者。此前,王宁利曾担任过北京同仁医院院长、党委书记、中华医学会眼科学分会主任委员等。
2.我国完成“基因编辑猪-人”肝脏异种移植。3月10日,中国科学院院士窦科峰团队联合空军军医大学西京医院肝胆外科主任陶开山团队开展的异种肝脏移植临床研究取得重大突破:成功将一只多基因编辑猪的全肝以辅助的方式移植到一位脑死亡患者体内。术中,移植肝脏恢复血流后即刻分泌胆汁,未见超急性排斥反应,已持续工作超96小时。该研究首次探索了“基因编辑猪-人”肝脏异种移植的可行性,在科学理论创新、核心技术攻关、军事医学应用等方面取得原创性突破。
3.儿童参加基本医保专项行动启动。国家医保局会同相关部门日前印发《关于开展儿童参加基本医疗保险专项行动的通知》,重点优化新生儿童参保流程,简化参保登记环节,鼓励地方探索凭出生医学证明办理新生儿参保。《通知》明确提出力争至2024年底,80%以上新生儿在出生当年参保;到“十四五”期末,儿童参保率稳中有升。
评审动态
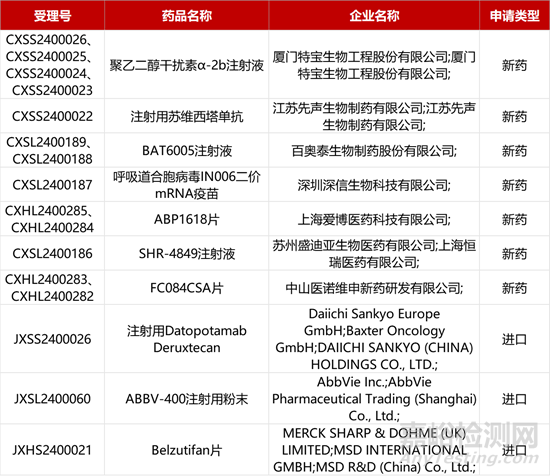
1. CDE新药受理情况(03月16日)
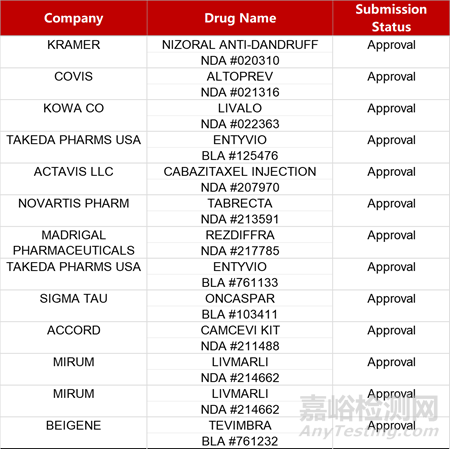
2. FDA新药获批情况(北美03月14日)