今日头条
兴齐儿童近视改良新药获批上市。兴齐眼药改良型新药硫酸阿托品滴眼液(SQ-729)获国家药监局批准上市,成为国内首款用于延缓儿童近视进展的低浓度硫酸阿托品滴眼液。在Ⅲ期研究中,与安慰剂组相比,硫酸阿托品滴眼液组在主要疗效指标上显示出了具有统计学意义的显著性改善,而且药物安全性良好,患者使用依从性好。有专业机构预测该产品上市的第3个完整年(2027年)将达到销售峰值101.8亿元。
国内药讯
1.云顶新耀引进结肠炎新药报产。云顶新耀从Arena公司(已被辉瑞收购)引进的口服选择性1-磷酸鞘氨醇(S1P)受体调节剂伊曲莫德(etrasimod)的新药上市申请获得了澳门药监部门受理,用于治疗中重度溃疡性结肠炎(UC)患者。去年3月发布于《柳叶刀》上的Ⅲ期ELEVATE UC 52研究显示,第52周时,etrasimod组患者达到32.1%(vs7.0%,p<0.001)的临床缓解率。该新药此前已获FDA和EMA批准上市,用于治疗中重度UC患者。
2.AZ/康诺亚ADC启动国际Ⅲ期临床。阿斯利康Claudin18.2靶向抗体偶联药物AZD0901(CMG901)在中国登记启动一项Ⅲ期临床,在表达Claudin 18.2的晚期或转移性胃及胃食管结合部腺癌的成人受试者中,比较AZD0901单药与研究者选择的方案作用于二线或二线以上治疗的有效性与安全性。这是一项国际Ⅲ期试验,项目中国部分由中山大学肿瘤防治中心徐瑞华博士牵头开展。
3.锐格口服GLP-1启动减肥Ⅱ期临床。锐格医药口服小分子GLP-1R激动剂RGT-075治疗肥胖的Ⅱ期临床完成首例患者入组。该项试验计划入组约69例肥胖患者(BMI在27-45之间),每天口服一次RGT-075或安慰剂,评估药物安全性、耐受性、药代动力学(PK)和药效学(PD)。顶线数据预计2024年下半年读出。此前,RGT-075已在美国开展用于治疗二甲双胍治疗后血糖控制不佳的2型糖尿病患者的II期临床。
4.诺诚健华湿疹新药亮相AAD2024年会。诺诚健华新型酪氨酸激酶2(TYK2)抑制剂ICP-332在AAD2024年会上公布了用于治疗中重度特应性皮炎(AD)的Ⅱ期临床最新数据。与安慰剂相比,ICP-332(80m、120mg)每日一次治疗组患者的EASI评分较基线改善的百分比变化更高(78.2%和72.5%,vs16.7%),达成EASI 75应答的比例更高(64%和64%,vs8%)。两个治疗组的总体不良事件发生率均与安慰剂组相当。
5.乐普胰腺癌ADC获快速通道认定。乐普生物TF靶向ADC新药MRG004A获FDA授予用于治疗胰腺癌的快速通道资格。值得一提的是,该产品胰腺癌适应症此前已获FDA授予孤儿药资格认定。TF的异常表达通常与肿瘤生长、血管生成、肿瘤转移和临床治疗预后差相关。乐普生物正在中美两国同步开展I/II期临床,评估MRG004A用于治疗胰腺癌、三阴性乳腺癌及宫颈癌的抗肿瘤初步疗效。
6.科士华创新TCR-T报IND。科士华生物1类生物制品“KSH01注射液”的临床试验申请获CDE受理。KSH01是该公司专有技术平台TCR-XFinder™及TCR-XPlanet™ T细胞数据库从患者体内快速筛选出的天然来源TCR序列细胞疗法,具有强效抗肿瘤活性。科士华计划开发KSH01用于治疗包括食管癌、胃癌、黑色素瘤、肉瘤、膀胱癌、喉癌等多种晚期实体瘤。
国际药讯
1.Epitomee/雀巢减肥胶囊报产。Epitomee公司与雀巢合作开发的“减肥胶囊”已通过510(k)途径向FDA递交上市申请。“减肥胶囊”含有可膨胀的生物聚合物,服用之后在胃部可膨胀成一个灵活的三角形,使胃部产生饱腹感,以帮助超重和轻度肥胖人群减重。在关键RESET研究中,受试者口服减肥胶囊24周后体重比基线减轻≥5%的比例达到56%;临床中没有发生与医疗器械相关的严重不良事件(SAE)。
2.Dermavant公司湿疹乳膏亮相AAD2024年会。Dermavant公司在AAD2024年会上公布其芳香烃受体调节剂Vtama(tapinarof 1%乳膏)治疗两岁以上儿童和成人特应性皮炎(AD)患者的两项Ⅲ期试验(ADORING 1和ADORING 2)积极结果。数据显示,两项试验均达到主要终点和关键次要终点,分别有57.1%和58.1%的Fitzpatrick皮肤类型IV、V、VI患者在第8周达到EASI75缓解。目前,Vtama用于≥2岁AD患者的sNDA正接受FDA监管审查。
3.CuraSen公司CNS新药Ⅱ期临床积极。CuraSen公司高脑透性β2肾上腺素受体(β2-AR)激动剂CST-2032联合β阻滞剂CST-107在治疗阿尔茨海默病或帕金森病相关轻度认知障碍(MCI)或痴呆患者的Ⅱa期临床获积极结果。数据显示,CST-2032/CST-107治疗能显著改善患者在多个认知领域的指标(包括记忆、注意力、执行功能、面部识别和冲动控制);且组合疗法安全性良好,没有发生严重不良事件。
4.NodThera公司帕金森新药早期临床积极。NodThera公司NLRP3炎症小体抑制剂NT-0796治疗帕金森病(PD)患者的Ⅰb/Ⅱa期试验结果积极。NT-0796(每日口服一次)治疗28天后,患者脑脊液中的关键促炎生物标志物(例如IL-1β、IL-6、CCL2、CXCL1和CXCL8)和神经退行性标志物(包括神经丝轻链(NfL)和sTREM2)平均水平显著降低;脑脊液测量结果显示,NT-0796在大脑中的有效浓度水平可维持超过24小时。此外,NT-0796总体耐受性良好。
5.遗传性肝病基因编辑疗法获批临床。IECURE公司基于两种AAV载体开发的基因疗法ECUR-506获英国药品和保健品监管局(MHRA)批准开展Ⅰ/Ⅱ期临床,拟评估用于治疗鸟氨酸氨甲酰基转移酶(OTC)缺乏症新生儿的安全性与初步疗效。这是一种由遗传缺陷导致的遗传性代谢障碍,常发生于新生儿。目前唯一针对早期发作的严重OTC缺乏症的纠正性治疗是肝移植。
6.Amylyx公司渐冻症新药III期研究失败。Amylyx公司创新复方制剂Relyvrio(AMX0035,苯丁酸钠/牛磺酸二醇)治疗肌萎缩侧索硬化(ALS)患者的III期PHOENIX研究未达到主要终点。与安慰剂比,AMX0035治疗第48周时患者肌萎缩侧索硬化功能评定量表(ALSFRS-R)评分较基线变化的统计不具显著性差异(p=0.667)。该项研究也未达到次要终点指标(生活质量结果评估、总生存期以及慢肺活量(SVC)衡量的呼吸功能等)。
医药热点
1.我国科学家发现新冠病毒新血清型。中国科学院微生物研究所等团队以小鼠血清交叉中和的方法,系统研究了新型的奥密克戎变异株XBB.1.16、EG.5、FL.1.5.1和BA.2.86等受体结合域抗原性,发现新冠病毒BA.2.86已经分化为一种新的血清型。基于XBB抗原的新冠疫苗存在被BA.2.86及其后续衍生变异株逃逸的风险。这将为未来针对多价广谱新冠疫苗和中和抗体的研发提供依据,并为全球新冠病毒的预防和治疗提供重要科学基础。
2.基于脑机接口的神经技术中心在米兰成立。意大利IRCCS圣拉斐尔医院和圣拉斐尔生命健康大学3月6日宣布与巴西尼科莱利斯先进脑科学研究所达成协议,在米兰市建立全球最先进的神经技术中心——圣拉斐尔神经技术中枢。该中心基于非侵入性脑机接口(nBMI)技术,将成为欧洲首个专注于大规模神经技术和神经康复协议的机构。
评审动态
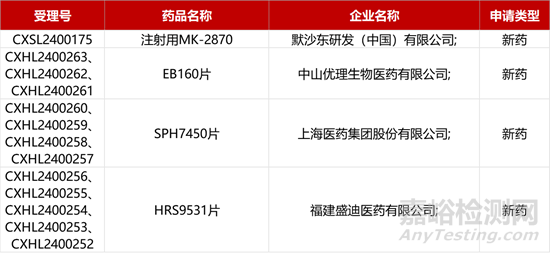
1. CDE新药受理情况(03月10)
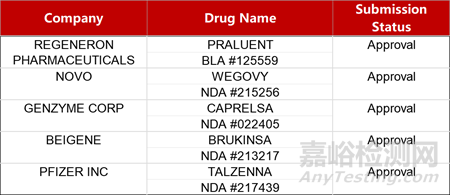
2. FDA新药获批情况(北美03月08日)