今日头条
复宏汉霖两款ADC获批临床。复宏汉霖申报的两款1类生物药HLX42和HLX43的临床试验申请分别获得国家药监局默示许可,针对的适应症均为晚期/转移性实体瘤。HLX42是一款靶向EGFR的ADC产品,已在对西妥昔单抗或EGFR TKI耐药的多种CDX/PDX模型中显示出较强的肿瘤抑制活性;与奥希替尼联用具有协同抗肿瘤潜力。HLX43是一款PD-L1靶向ADC药物,在多种PD-L1+ CDX和PDX模型中能诱导肿瘤消退,且安全性良好。
国内药讯
1.艾伯维JAK1抑制剂获批两项新适应症。艾伯维JAK1抑制剂乌帕替尼缓释片(商品名:瑞福)获国家药监局批准两项新适应症,用于治疗对非甾体抗炎药(NSAID)应答不佳且存在客观炎症征象(表现为C反应蛋白ICRPT升高和/或磁共振成像IMRI异常)的活动性放射学阴性中轴型脊柱关节炎(nr-axSpA)成人患者;以及用于治疗对一种或多种TNF抑制剂应答不佳或不耐受的活动性强直性脊柱炎(AS)成人患者。
2.亚盛Bcl-2抑制剂启动国际III期临床。亚盛医药Bcl-2抑制剂Lisaftoclax(APG2575)在clinicaltrials.gov网站上登记一项国际III期临床(试验代号:GLORA/APG2575CG301),拟评估APG-2575联合BTK抑制剂对比BTK抑制剂单药治疗既往接受过BTK抑制剂治疗的慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤 (SLL) 患者的有效性和安全性。该项试验拟纳入440例患者;主要终点为无进展生存期(PFS)。预计完成时间为2027年10月31日。
3.康宁杰瑞HER2双抗拟纳入突破性品种。康宁杰瑞开发的重组人源化抗HER2双特异性抗体注射液KN026获国家药监局拟纳入突破性治疗品种,联合化疗用于治疗HER2阳性局部晚期、复发或转移性的胃癌(包括胃-食管结合部腺癌)。在Ⅱ期临床中,KN026与化疗联合用药的客观缓解率(ORR)高达56%。石药集团旗下津曼特生物拥有KN026在中国内地的开发及商业化授权。
4.信达双重激动剂减重Ⅱ期临床积极。信达生物GLP-1R/GCGR双靶点激动剂玛仕度肽 (IBI362)高剂量9mg治疗肥胖患者的Ⅱ期临床48周治疗结果积极。数据显示,玛仕度肽9mg治疗较安慰剂使患者体重降幅达到18.6%(减重17.8公斤);该组减重超过5%和10%的患者比例分别达到83.7%和69.8%;研究中未发生严重不良事件。信达生物预计明年年初将递交IBI362用于减重的上市申请。
5.百吉TIL细胞疗法获批肝癌临床。百吉生物基于过继性免疫细胞治疗技术开发的肿瘤浸润淋巴细胞(TIL)治疗产品BST02注射液获FDA批准开展Ⅰ/Ⅱ期临床,拟评估用于治疗所有类型肝癌的安全性与有效性。BST02是从患者自身的肿瘤组织中采集并富集具有特异性识别肿瘤细胞抗原能力的淋巴细胞,通过体外扩增和功能优化后,将重新回输到患者体内以实现对肿瘤的杀伤效果。
6.恒瑞两款新药授权德国默克。恒瑞医药宣布与德国默克(Merck KGaA)就其自主研发的PARP1抑制剂HRS-1167和Claudin-18.2抗体药物偶联物(ADC)SHR-A1904达成合作许可协议。根据协议,德国默克将获得HRS-1167在中国大陆以外的全球开发、生产和商业化权利;SHR-A1904在中国大陆以外的全球开发、生产和商业化的选择权,及HRS-1167和SHR-A1904在中国大陆与恒瑞共同商业化的选择权。此项交易总金额将高达14亿欧元。
国际药讯
1.强生IL-23抑制剂肠炎Ⅲ期临床积极。强生IL-23抗体Tremfya(guselkumab)治疗中重度溃疡性肠炎(UC)的Ⅲ期临床(QUASAR)结果积极。此前,该项研究已达到主要终点,guselkumab治疗较安慰剂显著提高患者第12周时的临床应答率(61.5%vs27.9%)。最新数据显示,在第12周时仍未对IV诱导治疗产生临床缓解并随后接受额外12周皮下guselkumab治疗的患者中,有55%(66/120)在第24周达到临床缓解。接受guselkumab治疗的患者中有77.2%在第12或24周达到了累积临床缓解。临床中没有发现新的安全信号。
2.卫材/渤健Aβ单抗皮下制剂临床积极。卫材与渤健开发的Aβ单抗lecanemab(Leqembi)皮下制剂与静脉制剂对比,治疗早期阿尔茨海默病(AD)的Clarity AD研究扩展(OLE)研究最新数据公布于CTAD2023大会上。在第6个月时,与每两周1次静脉制剂相比,每周1次皮下制剂组患者的淀粉样蛋白斑块清除率高14%(两组患者脑淀粉样蛋白较基线分别降低40.3±2.27个单位和35.4±1.14个单位);药时曲线下面积(AUC)高11%;全身注射反应发生率更低。预计明年3月向FDA递交lecanemab皮下制剂的上市申请。
3.罗氏AD抗体早期临床积极。罗氏靶向淀粉样蛋白的单抗药物Trontinemab在CTAD大会上公布用于治疗轻中度阿尔茨海默病(AD)的Ⅰb/Ⅱa期试验积极结果。与罗氏之前所开发的Aβ单抗gantenerumab相比,trontinemab在患者体内脑脊液/血浆比率高8倍。高剂量(1.8mg)组有36%的患者12周后达到淀粉样蛋白清除;有75%的患者28周后实现淀粉样蛋白水平降至正常检测水平之下。罗氏计划招募更多患者并测试更高剂量。
4.赛诺菲BTK抑制剂皮炎II期研究失败。赛诺菲在Q3财报中披露,BTK抑制剂rilzabrutinib在治疗特应性皮炎的II期研究未达到主要终点。第16周治疗数据显示,rilzabrutinib治疗未能显著改善患者EASI评分,但其他重要临床指标均有明显改善。2021年,该新药用于治疗中重度天疱疮的III期PEGASUS研究也未能达到其主要或关键次要终点。
5.Aiolos公司融资加速TSLP单抗开发。Aiolos Bio公司宣布完成2.45亿美元超额认购A轮融资。2023年8月,该公司与恒瑞医药签订合作许可协议,获得恒瑞针对免疫疾病(如慢性阻塞性肺病和慢性自发性荨麻疹)开发的TSLP单抗候选药物AIO-001(SHR-1905)除大中华区外的全球开发、生产和商业化的独家权益。此轮融资将用于继续推进AIO-001在中重度哮喘患者中的Ⅱ期临床试验。
6.默沙东K药前三季度收入184亿美元。10月26日,默沙东公布2023Q3业绩报告,第三季度全球实现营收159.62亿美元,同比增长7%,前三季度收入合计454.85亿美元。PD-1抑制剂Keytruda第三季度销售额63亿美元(+17%),前三季度收入合计184.03亿美元(+19%)。九价HPV疫苗Gardasil/Gardasil 9第三季度销售额26亿美元(+13%),前三季度收入合计70.15亿美元(+29%)。基于第三季度的业绩表现,默沙东再次提高全球销售额预期为597亿美元至602亿美元。
医药热点
1.首都医科大学新校区动工。10月29日,首都医科大学新校区(校本部)在北京大兴区正式开工。首医新校区选址于大兴生物医药基地北扩区,包括校本部、研究型医院、首都医学科学创新中心三大建设项目,土地面积共计约1100亩。首期项目将建设博士、硕士研究生宿舍共6栋楼,位于北校区东侧,总建筑面积超10万平米。总体项目将于2027年底全面竣工,计划2028年投入使用。
2.广西将试管婴儿等医疗服务纳入医保。据广西壮族自治区医保局网站消息,《自治区医保局自治区人力资源和社会保障厅 自治区卫生健康委关于将部分治疗性辅助生殖类医疗服务项目纳入基本医疗保险和工伤保险基金支付范围的通知》日前正式发布。《通知》提出,将“取卵术”等部分治疗性辅助生殖类医疗服务项目纳入基本医疗保险和工伤保险基金支付范围。通知自2023年11月1日起执行。
3.上海开展儿童孤独症早期筛查干预工作。为进一步深化儿童早期发展工作,上海市将聚焦婴幼儿期在发育行为心理等方面的评估和干预,全面开展0-6岁儿童孤独症筛查干预工作并纳入儿童保健项目,儿童在6岁之前可得到11次筛查, 初筛服务可在辖区社区卫生服务中心获得,对异常的儿童做到早发现、早诊断、早干预。
评审动态
1. CDE新药受理情况(10月30日)
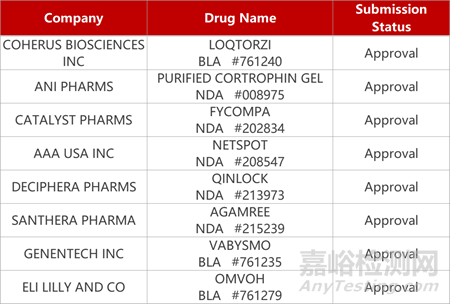
2. FDA新药获批情况(北美10月27日)