亚硝胺杂质已成为悬在药监部门与生产商头顶的达摩克利斯之剑,威胁着上市药品的质量与患者的用药安全。虽然亚硝胺杂质(Nitrosamines)也有可能是基因毒性杂质(Genotoxic Impurities),但基因毒性杂质和亚硝胺杂质是单独的两个评估模块,他们有各自细分的法规要求,亚硝胺杂质的控制更严格。
亚硝胺杂质还是要研发人员基于风险评估(评估几大要素包括工艺本身、回收溶剂、物料,包材,水等)、ICH限度计算以及三批检测结果来最终制定控制策略,具体如下所述:
一、 杂质限度制定
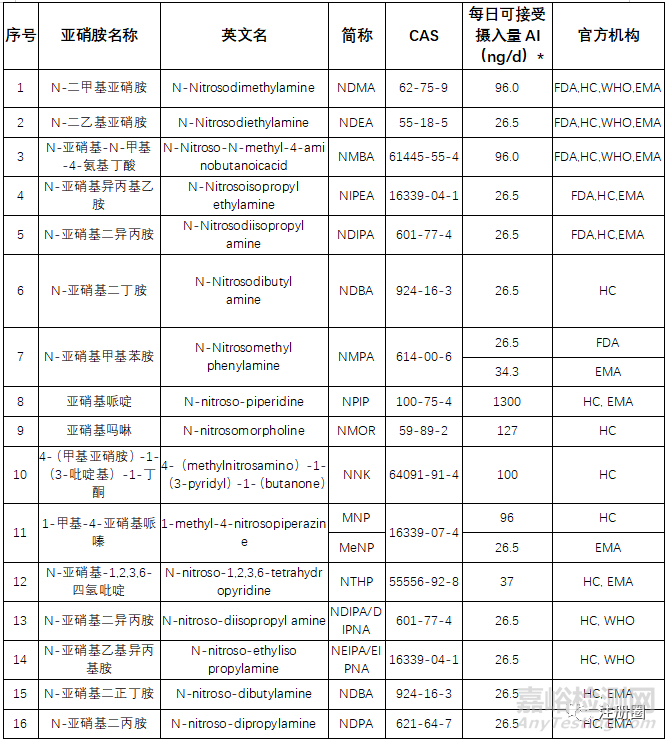
1、 仅有一种(亚硝胺)杂质:按照限度(AI/MDD)进行质量控制
①一般亚硝胺杂质/非NDSRIs:
▲表1-主流国家官方亚硝胺限度要求
②原料药亚硝胺相关杂质NDSRIs:
对于NDSRIs,FDA推荐了一种根据预测的致癌效力分类分配推荐限度的方法,如下表所示:
▲表2-NDSRIs物种预测致癌效力分类和相关AI限度
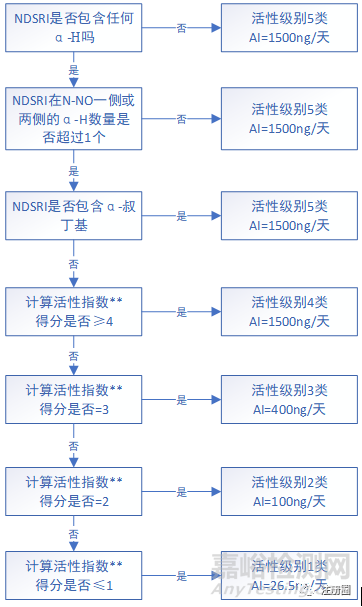
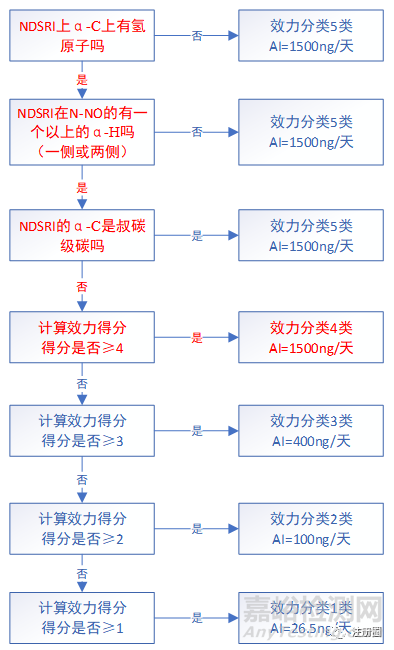
关于上表中NDSRIs预测致癌效力分类方法和相关AI推荐限度确认流程如下图所示:
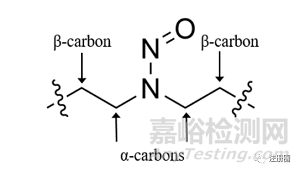
注:上述决策树中α-C及下文β-C含义如下图:
▲图1-NDSRIs致癌效力分类预测和确认推荐限度流程图
上图中致癌效力评分由如下3个部分组成:α-氢评分(表3)+失活特征评分(所有出现的结构特征得分之和) (表4)+激活特征评分(所有出现的结构特征得分之和) (表5)。
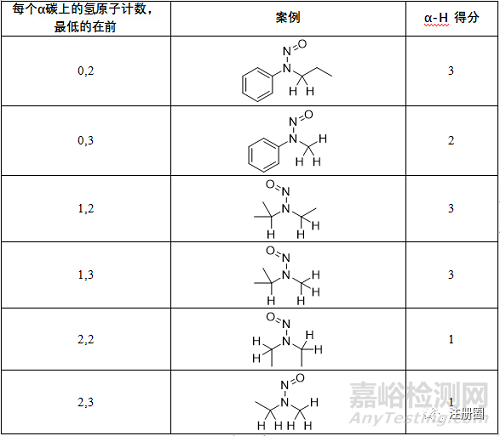
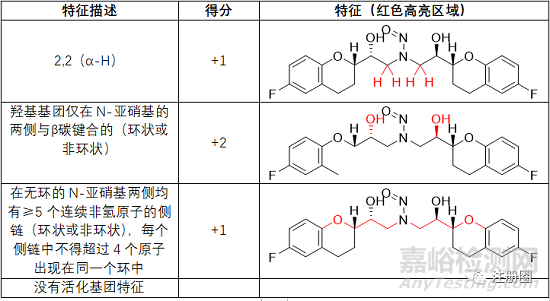
▲表3-每个α-碳上的氢原子计数和相应的α-H得分情况
注:当亚甲基α-碳不是乙基的一部分时,得3分。当亚甲基α-碳是乙基的一部分,得2分。
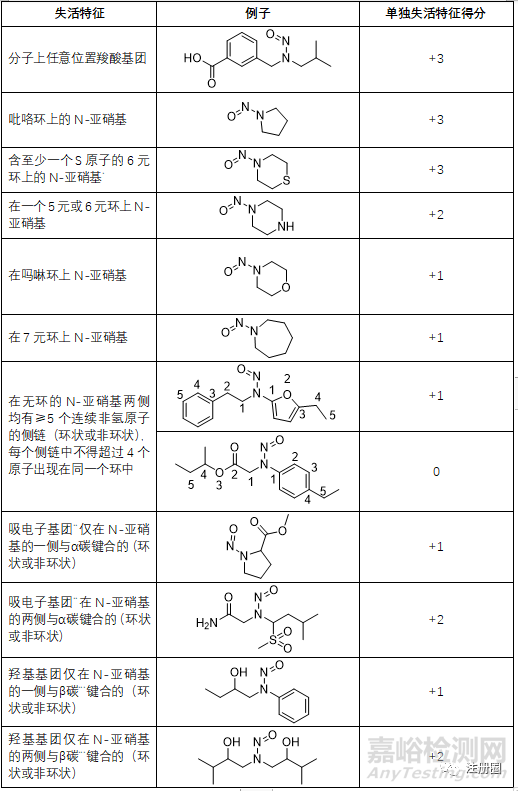
▲表4-失活特征及相关评分列表
注:*不包括N-亚硝基位于吡咯烷环、至少含有一个硫原子的六元环或吗啉环(全部分开计算)中的例子。
**不包括羧酸和芳基(单独计算),以及酮(数据冲突)。其它的吸电子基团示例仅限于Cross KP和Ponting DJ, 2021, Developing Structure-Activity Relationships for N-Nitrosamine Activity, Comput Toxicol, 20:100186中描述的那些,文献中它们被称为“β-碳吸电子基团”。
***β-碳必须处于sp3杂化状态,这一规则才适用。
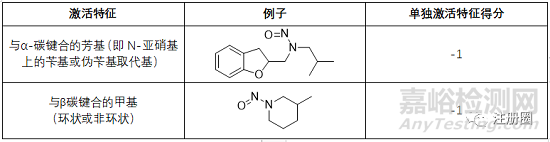
▲表5-激活特征和相关分数列表
举例说明:
案例1 N -亚硝基-l-奈比洛尔
效力得分=1+2+1=4,效力分类4级对应的AI推荐限度为1500ng/天。
案例2 N -亚硝基-氯胺酮
▲图2-N-亚硝基-氯胺酮致癌效力分类确认思路
其它FDA公布的NDSRIs推荐AI限度详见附件1(如需要附件,可转发文章,凭借截图联系注册圈管理员获取)。
2 、多于一种(亚硝胺)杂质
EMA:根据决策树两种控制方式(①所有检出的N-亚硝胺的总日摄入量不超过所检出的限度最低的N-亚硝胺的AI值;②各亚硝胺杂质实际检出值与其限度比值的总和不大于100%);
FDA:如果发现不止一种亚硝胺杂质(NDSRIs和/或小分子亚硝胺),且亚硝胺的总水平超过了基于最大日剂量的药品中最强效亚硝胺(限度最低的AI),则持有人应联系FDA当局。如果个别亚硝胺的推荐AI限度差异很大,FDA鼓励持有人提出一个不同于推荐的检测到的最有效的亚硝胺杂质AI的亚硝胺限度,并与FDA当局联系确认。
二、控制策略
FDA:原控制策略超过LOQ(0.03或0.02根据MDD)ppm需要报告;
法规来源:2021-02,Control of Nitrosamine Impurities in Human Drugs (Guidance for Industry):
The LOQ may be considered the reporting threshold for nitrosamine impurities (i.e., the limit above which an impurity should be reported in the certificate of analysis).
2023年8月更新后:NDSRIs限度根据已有毒理学数据已经放宽,但暂未明确更多配套控制策略。
法规来源:2023-08,Recommended Acceptable Intake Limits for Nitrosamine Drug Substance- Related Impurities (NDSRIs) Guidance for Industry
EMA:方法灵敏度做到限度的30%以下,并三批商业批数据未检出,API中定期检测;方法LOQ做到限度的10%以下,并三批商业批数据未检出,则可以免检。
法规来源:
Questions and answers for marketing authorisation holders/applicants on the CHMP Opinion for the Article 5(3)of Regulation (EC)No 726/2004 referral on nitrosamine impurities in human medicinal products :
If quantitative testing is performed as a routine control, the LoQ should be s of the acceptable limit based on the relevant acceptable intake (AI)for the respective nitrosamine impurity;
If quantitative testing is performed to justify skip testing, the LoQ of the analytical procedure employed should be s 30%of the acceptable limit based on the AI.
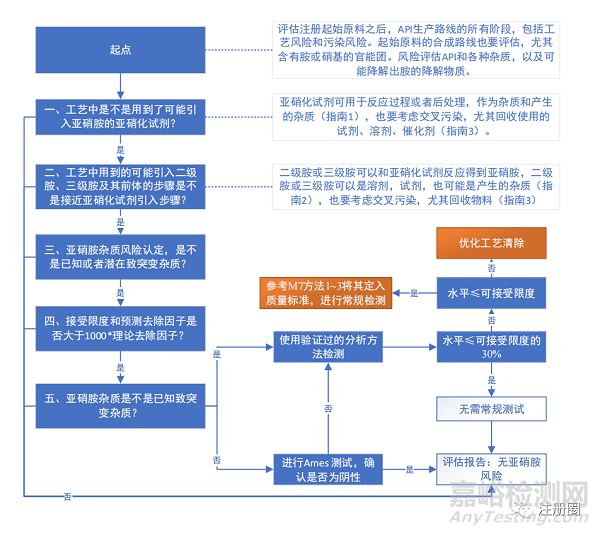
三、亚硝胺杂质研究决策树
▲图3-亚硝胺杂质研究决策树
对于亚硝胺杂质的研究需要我们遵循质量源于设计的理念,在项目开发过程中就充分将其考虑在内,比如:在工艺路线开发的时候,应尽可能减少或避免可能引入可能携带亚硝基试剂的溶试剂的使用,并对其制定严格的控制策略,包括供应商审计、质量保证协议、工艺路线清除设计等,都应该进行全面深入的设计。样品的检测在工艺路线确定以后,就应该完成相关分析方法的开发,对其制备样品进行检测和多批次数据收集,为未来限度制定提供充分的依据。
各国药监机构对于亚硝胺杂质的关注度日趋重视,国内外对于亚硝胺杂质的法规也日趋完善,尤其是原料药相关的亚硝胺杂质(NDSRIs)。NDSRI亚硝胺杂质通常没有明确确定的允许摄入量AI,为此FDA和EMA给NDSRI设定了苛刻的AI值。如FDA指定的临时AI为26.5ng/天;EMA为新的NDSRI设定了18ng/天的临时AI。随后EMA引入了178ng/天的临时AI,直到数据可以证明其确切的AI。这种临时AI的使用时间为1年过渡期。这种限度设定缺乏合理性,给药企带来了很大的挑战难度。
2023年7月底8月初,EMA及FDA先后发布了更加合理化的亚硝胺的控制策略,FDA在官方发布了基于上述控制策略一系列NDSRIs的临时AI限度。相对于上一版的总杂0.03ppm的控制要求,已经有了很大的改善。关于质量控制策略,企业也有了更多的发言权和参与机会。随着国内外研究的不断深入,毒理数据的日趋完善,将来有望改善亚硝胺风险评估、限度、研究控制策略及各国药监机构监管的日趋明朗和合理化。
参考文献
1. Questions and answers for marketing authorization holders/applicants on the CHMP Opinion for the Article 5(3) of Regulation (EC) No 726/2004 referral on nitrosamine impurities in human medicinal products,EMA/409815/2020 Rev.17;
2. Control of Nitrosamine Impurities in Human Drugs Guidance for Industry,FDA,February 2021,Pharmaceutical Quality/ Manufacturing Standards/ Current Good Manufacturing Practice (cGMP,Revision 1).
3. Nitrosamine impurities in medicines -Information for sponsors and manufacturers, TGA,20 July 2022.
4. WHO Information Note :UPDATE ON NITROSAMINE IMPURITIES,WHO,20 November 2019.
5. ICH. M7(R1) Assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals of limit potential carcinogenic risk [EB/OL].(2017-03-31)。
6. Workflows for Quality risk management of nitrosamine risks in medicines ,EPIFA,Version 2.0 ,Aug 2022.
7. Recommended Acceptable Intake Limits for Nitrosamine Drug Substance- Related Impurities (NDSRIs) Guidance for Industry,FDA, 04 August,2023.
8. Questions and answers for marketing authorisation holders/applicants on the CHMP Opinion for the Article 5(3)of Regulation (EC)No 726/2004 referral on nitrosamine impurities in human medicinal products,EMA,28 July,2023.