基因组药物自其概念诞生以来,经历了炒作和幻灭的时期,例如,十年前开创性的基因组药物Glybera获得批准后,激发了人们对其他基因组药物的期望。
然而,现实并不如人们所愿,在过去的3年里,基因药物研发遭遇了约30次挫折。
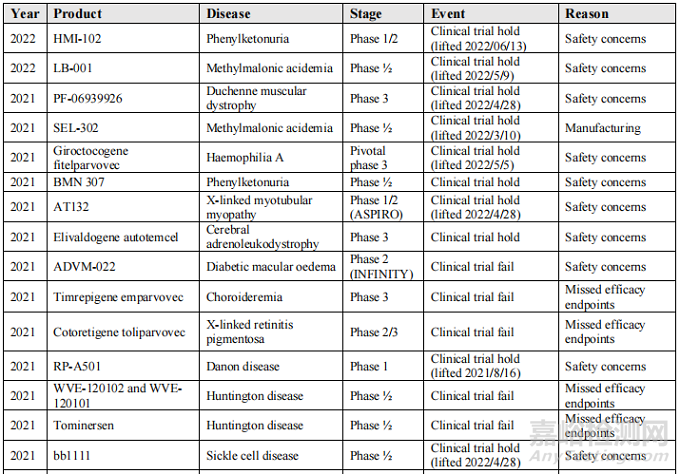
图:部分基因组药物受挫及原因
其中50%以上是由于安全问题,而与此相关的公司的估值也已经大幅下降。
对于当下的市场参与者而言(包括药企和投资者),以下两个关键问题亟待解答:基因组药物需要多长时间才能实现其潜力?以及相关市场会有多大?
1、研发热潮来势汹汹
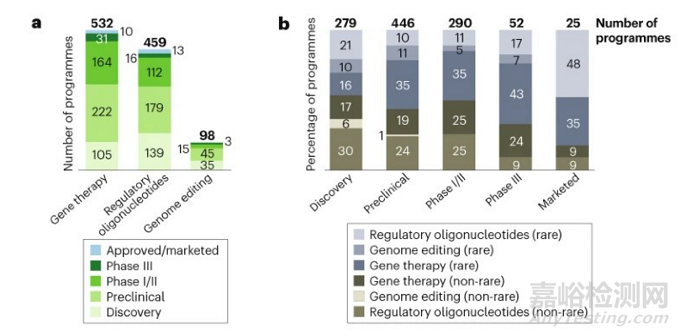
目前约有1200项基因组药物研发正在进行,而与庞大的管线相对的,是极少数的上市药品:目前只有不到20种基因组药物获得批准(相关信息在文章末尾),仅针对全球0.1%的遗传性疾病患者。
图:基因组药物研发管线现状
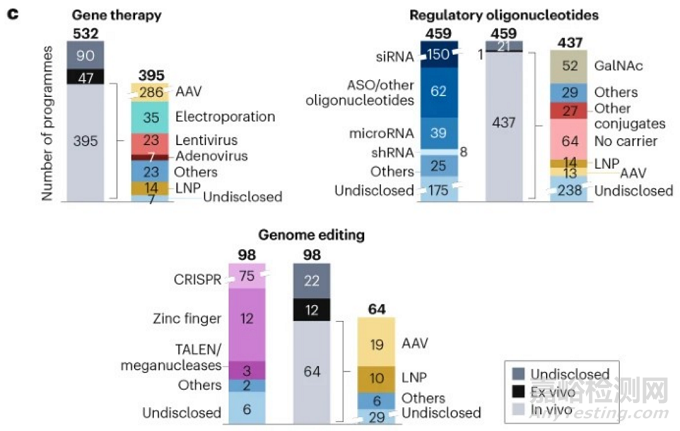
分领域来看,基因疗法(gene therapies)的管线占比最多,调节性寡核苷酸(regulatory oligonucleotides)上市产品最多,而基因编辑(genome editing)作为一种前沿技术,目前仍在探索之中。
图:基因组药物分领域情况
2、未来浪潮
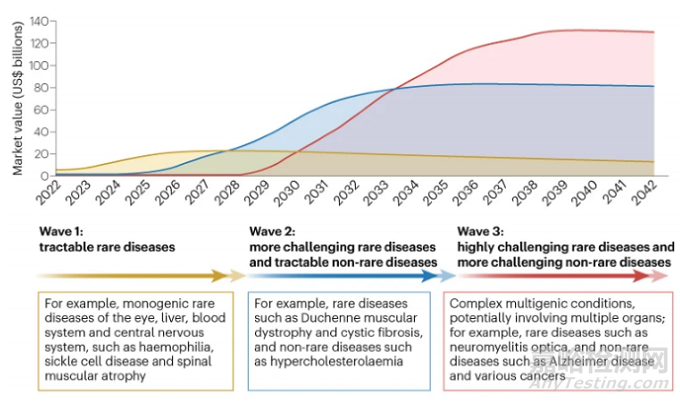
未来20年,基因组药物的获批上市可能会出现三波浪潮。
图:基因组药物未来浪潮及市场预测
随着基于 AAV 的基因疗法Luxturna获批用于治疗罕见视网膜疾病,几年前开始的第一波药物将在未来5至7年内继续流行,以治疗包括视网膜色素变性在内的罕见眼部疾病,因为它们的风险最低。然而,由于患者数量较少,它们的商业价值也最低。
第一波浪潮中的其他单基因疾病的疗法,如脊髓性肌萎缩症(获批药物包括反义寡核苷酸药物Spinraza和基于 AAV 的治疗药物Zolgensma)、乙型血友病(基于 AAV 的治疗药物Hemgenix)、和镰状细胞病。合并来看,上述适应症在美国、德国、英国、日本等7个发达国家市场中的患者人数约100万。
第二波预计将在未来3~10年,始于2021年siRNA 疗法Leqvio获批用于治疗成人原发性高胆固醇血症(杂合子家族性和非家族性)或混合型血脂异常。这可能为难治性非罕见疾病(如高胆固醇血症)和更具挑战性的罕见疾病(如杜氏肌营养不良症)的组合提供治疗,在7个发达国家市场约有5500万患者。
为了充分解锁这一波疗法的潜力,需要器官靶向的发展,可以通过抗体-寡核苷酸结合物和寡核苷酸转运载体等新兴技术加速这一过程。
最大的商业价值在第三波,预计将在8到20年后形成。这一浪潮涵盖的疾病可能包括多发性硬化症在内的最具挑战性罕见疾病,以及如阿尔茨海默病、癌症这样的非罕见疾病。
这波治疗的时间和程度将取决于技术进步,如穿透实体瘤组织和靶向相关器官的能力,以及对更复杂疾病(如阿尔茨海默病)发病机制理解的进展。
3、研发之外的挑战
未来20年基因组药物领域如何发展,除了研发因素之外,还取决于如何解决大规模制造、监管和医疗报销等关键挑战。
例如,目前基于 AAV 的疗法的制造流程使用基于细胞的系统,这些系统很难规模化,致使产量受限。
而监管机构对于基因组药物的持久性、一致性和疗效的质疑还将持续,这将导致需要对疗效进行长期临床观察。
在商业方面,目前基因组药物的价格普遍较高(Luxturna定价85万美元,Hemgenix定价350万美元)。为了使患者能够负担得起基因治疗,可能需要新型医疗报销策略。
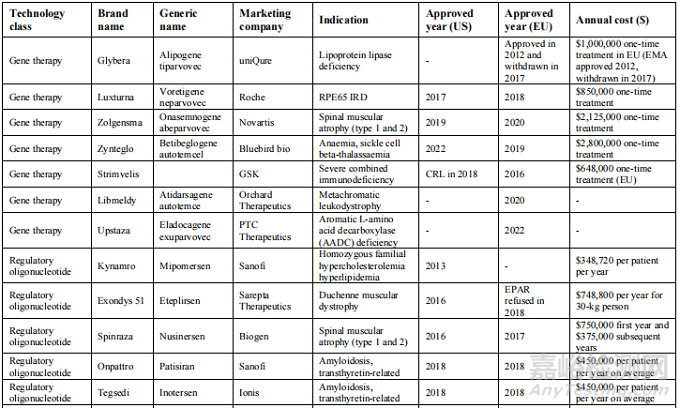
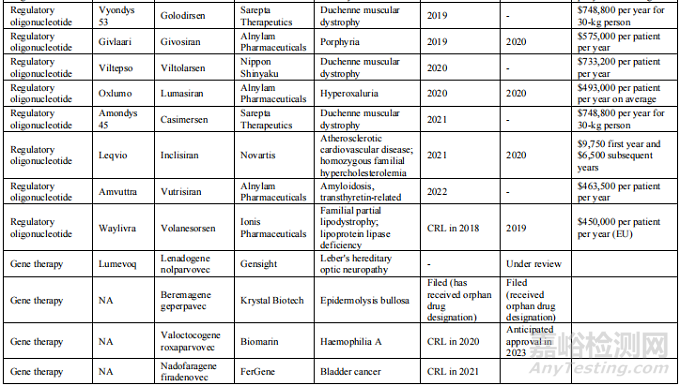
附表:迄今为止,美国和欧洲批准的基因组药物情况
参考资料:Genomic medicines: the coming waves? [Xie et al., Nature Reviews Drug Discovery, June 2023]