今日头条
康朴新型分子胶完成SLE临床入组。康朴生物E3泛素连接酶复合物CRL4-CRBN调节剂KPG-818在美国开展治疗系统性红斑狼疮(SLE)的Ⅱa期临床完成全部患者入组。公布在ACR2022年会上的Ⅰb期临床数据显示,KPG-818具有良好的剂量-暴露量相关性,血药浓度在7天内达到稳态;能诱导Aiolos的显著降解、B细胞耗竭、pDC的下调和Treg的上调;并具有良好的耐受性。
国内药讯
1.恒瑞JAK1抑制剂皮炎Ⅲ期临床积极。恒瑞旗下瑞石生物JAK1抑制剂艾玛昔替尼在2023年美国皮肤病学会年会上公布用于治疗中重度特应性皮炎(AD)的Ⅲ期临床(QUARTZ3)积极结果。与安慰剂相比,艾玛昔替尼(8mg或4mg)治疗组16周时达到研究者总体评分(IGA)为0(皮损完全清除)或1(几乎完全清除),且较基线下降≥2分(IGA应答)的患者比例(42.0%和36.3%)显著更高,达成EASI-75应答的患者比例(66.1%和54.0%)具统计学显著性。而且药物的总体耐受性良好。
2.先为达GLP-1R激动剂启动减肥III期临床。先为达生物开发的长效GLP-1类似物XW003(ecnoglutide)登记启动一项III期临床(SLIMMER),拟评估用于成年超重或肥胖受试者中的减重疗效。该项试验的主要研究者由北京大学人民医院医学博士纪立农担任。在IIb期临床临床中,XW003组(2.4mg)患者的平均体重较基线下降11.1%(10.9kg),而利拉鲁肽组这一比例为7.9%(8.1kg),P=0.009;两组体重下降≥5%的患者比例分别为88.5%和70.4%,体重下降≥10%的患者比例分别为57.7%和33.3%。
3.南京爱德程TKI拟纳入突破性治疗品种。爱德程医药1类化药AL8326片获CDE拟纳入突破性治疗品种,用于治疗至少接受二线治疗方案后进展或复发的小细胞肺癌。AL8326是一款多靶点酪氨酸激酶抑制剂(TKI),主要抑制FGFR、VEGFR、Aurora B等蛋白。该新药目前正在国内开展多项临床研究,适应症涉及小细胞肺癌、非小细胞肺癌、妇科恶性肿瘤、胰腺癌为主的晚期肿瘤等。
4.中生复诺健溶瘤病毒获批肝癌临床。中生复诺健生物重组人IL12/15-PDL1B单纯疱疹Ⅰ型溶瘤病毒注射液(Vero细胞)的第三项适应症获国家药监局临床许可,拟联合卡瑞利珠单抗治疗既往至少接受过一线治疗方案治疗的晚期原发性肝细胞癌。这是复诺健生物专有SYNERLYTIC™技术平台开发的首个产品,它同时携带IL12、IL15和IL15受体α亚基(IL15/15RA)和PD-L1阻断肽(PDL1B)的基因,具有协同抗肿瘤的治疗潜力。
5.荣昌MSLN-ADC获批实体瘤临床。荣昌生物靶向新型间皮素 (MSLN)的ADC药物注射用RC88获国家药监局临床默示许可,拟联合特瑞普利单抗开展Ⅰ/IIa期临床,评估联合用药治疗间皮素表达阳性的恶性肿瘤(如胸膜间皮瘤、腹膜间皮瘤、肺腺癌、胰腺癌、卵巢癌、胃癌等)的效果。RC88可通过靶向结合MSLN阳性的肿瘤细胞,介导抗体的内吞,从而有效地将细胞毒素定向传递给癌细胞,实现较好的肿瘤杀灭效果。
6.上海民为GLP-1R/GCGR/GIPR激动剂报IND。民为生物1类生物制品MWN101注射液的临床试验申请获CDE受理。MWN101是国产首款申报临床的GLP-1/GCG/GIP-Fc融合蛋白,拟开发用于治疗2型糖尿病和肥胖。全球范围内,已有4款同类产品进入临床开发,其中韩美制药的HM15211和礼来的retatrutide研发进展最快,目前已处于II期临床阶段。
7.基石引进ROR1-ADC转化医学研究积极。基石药业在2023年World ADC London会议上公布其引进的ROR1 ADC药物CS5001转化医学初步研究结果。数据表明,ROR1在多种实体瘤组织中有表达,且CS5001对多种表达ROR1的血液瘤及实体瘤细胞展现出较强的细胞毒性。CS5001在实体瘤CDX和三阴性乳腺癌PDX模型中也显示出明显的对ROR1表达的依赖性趋势。ROR1表达将作为CS5001药效的潜在预测性生物标志物在Ⅰ期临床中进行探索。
国际药讯
1.Incyte公司JAK1抑制剂白癜风IIb期临床成功。Incyte公司口服JAK1抑制剂povorcitinib治疗非节段型白癜风的IIb期研究达到主要终点。与安慰剂相比,povorcitinib(15mg、45mg和75mg)治疗组第24周时全身白癜风面积评分指数显著改善(-19.1%、-17.8%和-15.7%,vs+2.3%);达到T-VASI较基线减少≥50%的患者比例更高(10.5%、15.2%和5.6%,vs3.0%)。药物的耐受性良好,没有出现与治疗有关的严重不良反应。
2.创新IL-17A抑制剂汗腺炎IIb/III期临床积极。Affibody公司与ACELYRIN公司开发的IL-17A融合蛋白拮抗剂izokibep (IMG-020) 在AAD2023年会上公布用于治疗中重度化脓性汗腺炎 (HS) 的IIb/III期临床积极结果。12周治疗数据显示,脓肿和炎性结节减少至少50%、75%、90%和100%的患者比例分别达到71%,57%,38%和33%。安全性数据与之前研究一致。创响拥有该新药的大中华区及韩国的商业化权益。
3.新型抗体-TCR-T疗法获批临床。Estrella Biopharma公司CD19-重定向ARTEMIS T细胞疗法EB103获FDA批准开展I/II期临床,评估用于治疗复发或难治性B细胞非霍奇金淋巴瘤患者,包括HIV相关淋巴瘤以及原发性和继发性中枢神经系统(CNS)淋巴瘤。EB103转载的抗原识别结构包含CD19抗体的抗原结合域Fab与γδ TCR的效应结构域,同时在共刺激域上也连接靶向CD19的scFv片段,旨在与癌症靶标接触时被激活和调节的同时,降低CRS的发生。
4.肠道菌群或可调控CAR-T治疗效果。德国癌症研究中心、美国MD安德森癌症中心联合团队在期刊Nature Medicine上发表他们跟踪评估B细胞白血病和淋巴瘤经治患者接受CAR-T治疗前后两年的前瞻性研究成果。与未接受抗生素治疗的患者相比,在CAR-T细胞治疗前接受广谱抗生素治疗的患者往往具有更高的肿瘤复发和全身炎症。研究揭示肠道微生物组和CAR-T细胞治疗结果之间的强烈关联。
5.武田加码细胞治疗赛道。武田扩大与基因编辑药企Artisan Bio的合作,旨在进一步利用后者的基因组编辑技术,开发通用细胞疗法。Artisan是一家研发服务型药企,其主要技术包括同种异体编辑、隐形编辑和双 CAR敲入技术。根据协议,Artisan Bio将获得额外资金,为武田提供基因组编辑工具协助细胞治疗项目的研发;武田将负责合作产品的开发、制造和商业化。
医药热点
1.中国睡眠大数据中心成立。3月19日,由中国睡眠研究会等联合发起的中国睡眠大数据中心正式成立。中国科学院院士、北京大学第六医院院长陆林在成立仪式上表示,该中心将借助大数据分析筛查睡眠相关疾病,建立立体式分级诊疗体系,进而减少个人睡眠障碍的患病率和患病风险。在中国,成人失眠发生率高达38.2%,睡眠问题引发的慢性病中发病率前三的分别为肥胖症、高血压和糖尿病。
2.全球首位女性艾滋病“治愈者”出现。近日,美国威尔康奈尔医学院的研究人员在Cell 期刊上发表题为" HIV-1 remission and possible cure in a woman after haplo-cord blood transplant "的论文。研究显示,一例同时患有急性髓系白血病(AML)和艾滋病的混血女性在接受干细胞移植37个月后,停止了抗艾滋病毒治疗,之后她的体内连续18个月没有检测到HIV-1。该患者成为继“柏林病人”、“伦敦病人”、“杜塞尔多夫病人”之后,第四例经发表的艾滋病治愈病例,被称为“纽约病人”。同时,也是全球首次成功治疗的女性艾滋病患者。
3.日本发生由诺瓦克病毒引发的食物中毒。据日本共同社18日晚报道,日本广岛市一个婚礼现场近期发生集体食物中毒,多人在用餐后出现呕吐、拉肚子、发烧等症状,患者检出诺瓦克病毒。冬季到初春期间是诺瓦克病毒流行期,日本多地近期已发生诺瓦克病毒引发的食物中毒。日媒提醒民众勤洗手,吃的食品尽量充分加热。
评审动态
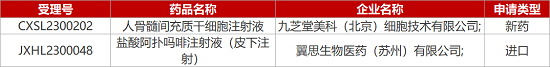
1. CDE新药受理情况(03月20日)
2. FDA新药获批情况(北美03月17日)