为了鼓励以临床价值为导向的药物创新,现行《药品注册管理办法》明确提出了4种加快上市注册的程序。对于早期临床试验数据可证实药物疗效并能预测其临床价值的创新药,经评价后可以通过附条件批准工作程序,在完成确证性临床研究之前上市,让有严重危及生命且尚无治疗手段的患者获得更多延长其生命或改善其生活质量的治疗机会。附条件批准工作程序可以缩短药品上市前的临床研发时间,因此其配套政策和审评标准备受关注。
本文以肿瘤创新药为切入点,对我国附条件批准的政策要求和审评过程中已经形成的标准进行系统的梳理,并尝试对附条件批准实施过程中遇到的问题进行分析并提出建议,供业界参考。
现行《药品注册管理办法》(下文称“办法”)于2020年7月1日起正式实施[1]。与2007版办法相比,现行办法最大的变化之一是明确提出了4种药品加快上市注册程序,即突破性治疗药物、附条件批准、优先审评审批及特别审批程序,鼓励以临床价值为导向的药物创新。
对于被列入加快上市注册程序的药品,药品监督管理部门及专业技术机构将给予政策和技术支持,提供更多的技术指导,优先配置沟通交流和审评资源并尽可能缩短审评时限。4种加快上市注册程序中,附条件批准直接以缩短药物临床试验的研发时间为目的,其配套政策和审批标准最受业界关注。在附条件批准的适用情形中,“治疗严重危及生命且尚无有效治疗手段疾病的药品”相比其他2种情形的潜在对象相对广泛,其临床研究的设计要求和审评标准更易成为持续性焦点,监管挑战也更大。
现行办法实施仅2年余,但在此之前已有多个国产抗肿瘤(包括血液系统恶性疾病)创新药基于附条件批准的理念获批上市; 在附条件批准正式成为中国加快上市注册程序之一后,肿瘤也是附条件批准药品中占比最高的适应证类型。因此,肿瘤适应证是附条件批准的先行者和积极践行者,也是监管思考相对成熟的适应证。
本文以肿瘤创新药为切入点,对我国附条件批准的政策要求和审评过程中已经形成的标准进行系统的梳理,供业界参考。本文亦尝试对附条件批准实施过程中监管部门面临的关键挑战进行分析并提出建议。
1、我国附条件批准的基本涵义
现行办法明确了可申请附条件批准的3种情形,并且对附条件批准的申请、流程、上市后应履行的“条件”提出了要求。在具体实施过程中,可参考的技术性文件还包括国家药品监督管理局2020年7月7日发布的《药品附条件批准上市申请审评审批工作程序(试行)》[2](下文称“工作程序”)和国家药品监督管理局药品审评中心2020年11月19日发布的《药品附条件批准上市技术指导原则(试行)》[3]。
实施附条件批准上市的目的在于“缩短药物临床试验的研发时间,使其尽早应用于无法继续等待的危重疾病或公共卫生方面急需的患者”[3]。在可获得疾病病理生理特征、药物机制、临床前安全性和药效学研究结果支持的前提下,若药物已有临床研究数据所反映的治疗获益已经足够大,以至于目标适应证人群继续等待常规批准所需要的临床研究证据所面临的生命或健康损失,极有可能远超因临床获益尚未得到确证带来的风险,从而得出“药物临床试验已有数据可证实药物疗效并能预测其临床价值”的结论[1],则可在药物完成确证性临床试验前基于替代终点、中间临床终点或早期临床试验数据批准药物上市。
附条件批准并不意味着降低新药上市的技术要求。递交附条件批准上市许可申请的肿瘤创新药物,药学、药理毒理学要求与常规批准上市药品相同,申请人也不应该以“开展上市后研究”作为弥补临床试验设计或数据缺陷的条件提出附条件批准申请。药物在获得附条件批准上市后,上市许可持有人(简称“持有人”)应继续按照常规批准的要求开展确证性临床试验,以全面支持药物的获益风险评价。
全球范围内已有多个药品监管机构为鼓励危重疾病领域的药物创新,向工业界提供加快注册程序。表1将我国的“附条件批准”与美国、欧盟和日本药品监管机构实施的类似程序进行了比较。虽然各国监管机构在技术细节上存在差异,但整体原则是相似的,即对于严重威胁生命或患者生活质量的疾病,如果新药现有数据呈现良好的获益风险比且可预测其临床价值,可以在完成一般新药注册上市所需要的确证性研究前提前获批上市。

2、境内获附条件批准的抗肿瘤药品
自现行办法实施以来,截至2022年9月1日,已有32个化学药品或单抗类生物制品的37个肿瘤适应证在境内获附条件批准上市(见表2)。在附条件批准工作程序正式落地之前,西达本胺、吡咯替尼、信迪利单抗、特瑞普利单抗、卡瑞利珠单抗和盐酸安罗替尼等药品已通过与现行“附条件批准”相似的研发策略获得首个适应证的批准。
在现行办法实施初期的过渡阶段,部分境外已上市的药品,因其境外数据显示出突出的治疗获益,中国患者临床需求迫切且存在种族敏感性的可能性极小,在中国受试者数据非常有限时或者完全基于境外数据获得“附条件批准”。这些药品实质上是沿用了现行办法实施前的“有条件批准”,即上市后须在中国受试者中补充开展临床研究,其本质与现行办法中定义的“附条件批准”存在区别。
对附条件批准的抗肿瘤药品关键性注册研究设计思路进行总结,可以分为以下3种模式:
① 单臂研究注册:绝大多数附条件批准的药品在无治疗手段的末线肿瘤患者中开展单臂设计的关键性注册研究,最常用的替代终点是客观缓解率(ORR)相比历史数据的突出改善。在以缓解率作为主要疗效指标的单臂设计研究数据中,缓解持续时间是评价缓解质量的关键指标,也是通过缓解率合理预测临床获益的重要支持性数据。
② 小样本量Ⅱ期随机对照研究注册:相比单臂研究,以替代终点作为主要研究终点开展小样本量的随机对照研究可以更直接地反映药品的治疗获益。吡咯替尼即是基于一项包括128例复发或转移性乳腺癌患者的Ⅱ期临床试验结果[8],获得了“联合卡培他滨治疗表皮生长因子受体2(HER2)阳性、蒽环类或紫杉类化疗治疗失败的复发或转移性乳腺癌患者”适应证的附条件批准。该研究以拉帕替尼联合卡培他滨方案作为对照,在末例受试者至少接受12个周期治疗时,试验组和对照组的主要疗效指标即研究者评估的ORR分别为78.5%和57.1%; 试验组相比对照组的无进展生存时间[中位值分别为18.1和7.0个月,风险比(HR)=0.363]和总生存期[尚未成熟,中位值分别为未达到和16.2个月,HR=0.362(95%CI: 0.160~0.815)]优势,为附条件批准提供了非常有价值的支持性数据。
③ 确证性研究早期数据注册:关键性注册研究采用适应性设计,以替代终点或期中分析结果提出附条件批准申请,再以临床终点主要分析结果支持常规批准,是一种更为稳妥和高效的注册策略。全球Ⅲ期临床研究AMY3001中,达雷妥尤单抗皮下注射联合标准治疗CyBorD(环磷酰胺、硼替佐米、地塞米松)方案与CyBorD方案相比,主要疗效指标血液学完全缓解率得到了显著改善(53.3%vs18.1%); 中位随访11.4个月时,主要器官衰竭无进展生存期(MOD-PFS)期中分析结果表明试验组相比对照组HR=0.580(95%CI: 0.363~0.926,两组均未达到中位值),主要器官衰竭无事件生存期(中位值分别为未达到vs8.8个月,HR=0.39,95%CI: 0.27~0.56)也得到了显著的延长[9]。
基于上述研究结果,达雷妥尤单抗(皮下制剂)获得了“新诊断的原发性轻链型淀粉样变”适应证的附条件批准。由于MOD-PFS分析为预设的中期分析(计划事件的43.5%),名义P值(0.0211)未越过预先规定的终止界值,因此研究还将继续进行,以MOD-PFS的最终分析结果以及更成熟的总生存期数据支持常规批准[9]。
3、附条件批准沟通及审评过程中的关注重点
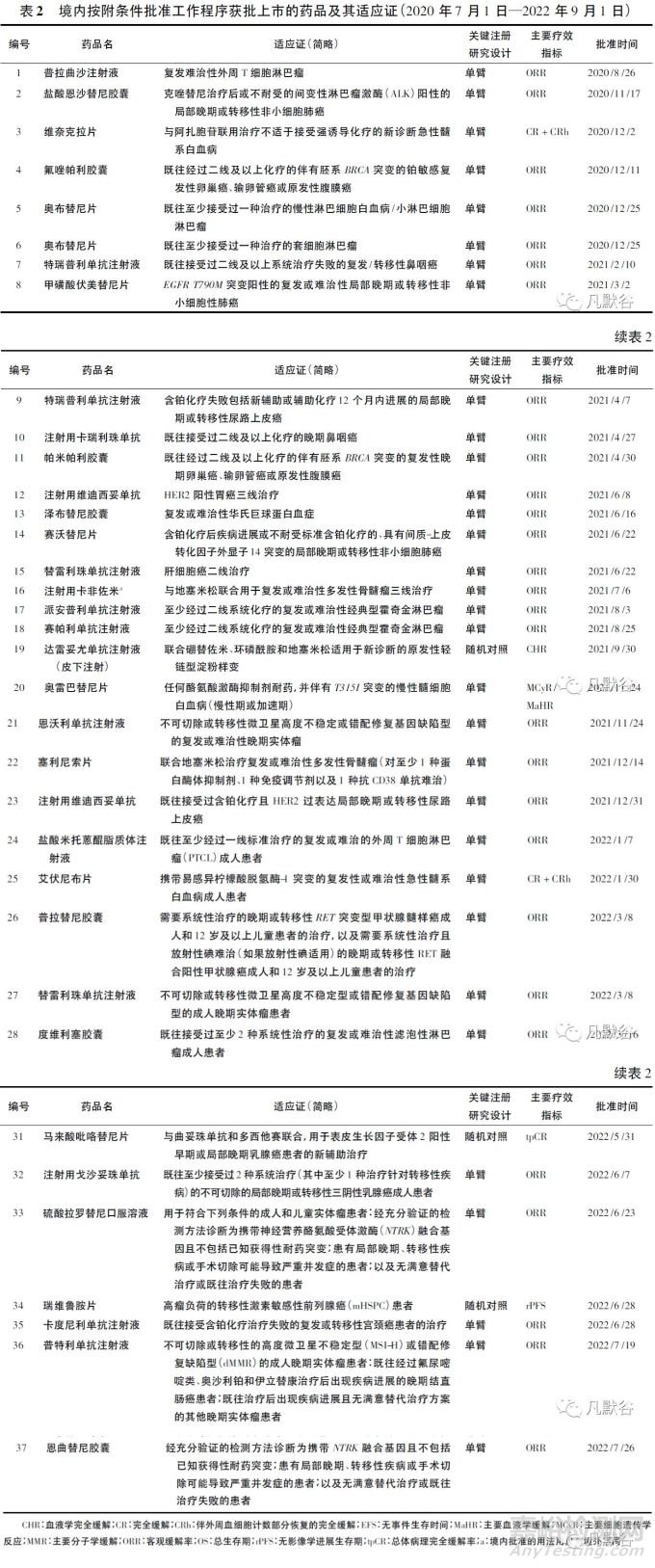
相比常规批准,附条件批准在前期沟通、技术审评和上市后要求方面必然有所不同(见图1)[2-3]。附条件批准的适用性和技术要求可能受目标适应证的特征和药物的创新程度影响,并且随临床实践的变化而发生实质性的改变,凸显了沟通交流的重要性。
在抗肿瘤创新药附条件批准的沟通交流中,应该重点解决以下问题:
① 目标适应证所对应的附条件批准适用情形。多数肿瘤有相对标准的治疗路径,还有部分肿瘤因为靶向药物的出现呈慢病化趋势,申请人应该分析目标适应证当前最亟待解决的临床问题,结合药物的作用机制和已有临床数据所反映的潜在优势定位目标人群,是无有效治疗手段的复发难治患者还是已有标准方案的新诊断患者,或是采用适当的生物标志物筛选耐药或预后更差的亚组,不同的人群定位将对应不同的附条件批准技术要求,对研发计划的制定产生重要影响。
② 支持附条件批准关键性注册研究的设计思路。单臂研究通常适用于经现有治疗手段充分治疗后反应不佳或多次复发,且无有效治疗手段的末线肿瘤患者。如果目标人群有标准治疗或推荐治疗方案,采用随机对照研究验证试验药/方案相比现有治疗手段的优势是更适宜的设计思路。
③ 替代终点是否“很可能预测临床获益”,或拟采用的中间临床终点能否预测长期临床获益。申请人可以通过相同肿瘤类型的既往数据进行论证,但需要注意药物的作用机制也可能对替代终点/中间终点与临床终点之间的相关性或相关程度产生影响。例如: 通常认为肿瘤缩小的影像学证据(客观缓解)和缓解持续时间能合理预测总生存期的改善,但免疫检查点抑制剂程序性死亡受体1(PD-1)单抗在不同肿瘤中的确证性研究结果却提示最初的ORR改善并不总能很好地预测长期生存获益[10]。因此,创新药如果能够同时提供反应替代终点和临床终点改善程度的早期临床研究数据并加以分析,是证明二者相关性的有力依据。
④ 何种限度的替代终点或中间临床终点改善可以被认为是“明显改善或明显疗效”。一般意义的疗效改善是不能支持创新药物获得附条件批准的,申请人应该提出合理的替代终点改善目标并论证这一目标极有可能转化成临床获益。论证可能会非常困难,新药审评中不乏替代终点改善非常可观却未能成功转化为长期生存获益或转化程度远低于预期的案例。维奈克拉联合小剂量阿糖胞苷(LDAC)治疗不适合接受强化治疗的急性髓细胞白血病(AML)患者,将完全缓解率(CR,包括伴外周血细胞计数部分恢复)由LDAC的15%提高到47%,却未获得总生存期(OS)的改善(HR=0.75,P=0.11)[11]。因此,附条件批准并非只关注替代终点是否达到预期目标,已经获得的临床终点数据是预测临床获益时非常关键的审评依据。
⑤ 确证性研究的具体要求。附条件批准是加快药物上市的注册路径,但不应该影响临床研发计划的正常推进,更不能成为中断或延迟开展确证性研究的理由。申请人应该在沟通附条件批准上市技术要求的同时,就确证性研究的具体要求与审评部门达成一致。按照一般的研发规律,如果支持附条件批准的临床研究结果积极,申请人应该尽快启动确证性研究。附条件批准的药品注册证书将载明具体的确证性研究,原则上,持有人不应以研究进行不顺利或结果与预期不相符等原因,对确证性研究的目标人群、治疗方案、对照治疗、主要疗效终点等要素进行实质性变更。
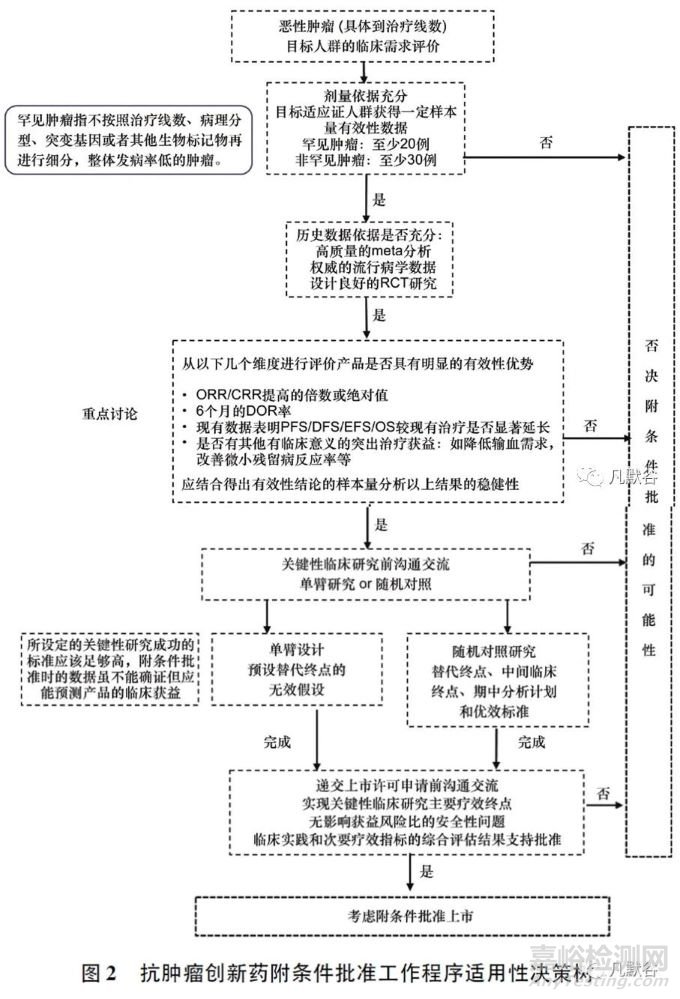
4、附条件批准适用性的决策过程
附条件批准适用性决策过程中的考虑要点和一般标准如图2所示。创新药应基于本品已获得的临床研究数据与审评部门展开附条件批准的沟通交流,而不是以同类药物的用药经验作为沟通基础。一般而言,至少需要在目标适应证人群中获得20~30例受试者(因瘤种而异)的有效性数据后,审评部门才会启动附条件批准的沟通交流。在缺乏可靠的历史数据时,申请人应考虑开展小规模的随机对照研究作为附条件批准适用性的决策依据。
需要说明的是,一个药品是否可以获得附条件批准,受到其创新性、申请人和学术界对产品机制和疾病的了解程度、目标适应证人群临床需求的迫切程度等多方面因素的影响,对所有附条件批准提出一个完全量化和固化的决策标准是不切实际也有失公平的。
由于附条件批准程序的核心是以临床价值为导向,审评部门在每个沟通环节的建议均以解决目标治疗人群当时的临床需求为前提,药物最终是否可获得附条件批准上市,将取决于目标适应证人群在做出监管决策时可获得的治疗手段及临床数据所体现的治疗优势。这意味着申请人在制定整体临床研发计划时应具有前瞻性,并且在临床实践发生重要变化时及时调整研发策略。
5、附条件批准工作程序实施过程中的监管问题
对附条件批准工作程序实施过程发现的重要问题进行梳理并尝试提出解决建议。
1)药品获得附条件批准后,对其后相同适应证的附条件批准申请的影响
在沟通交流阶段,同期可能有多个药品在同一适应证人群中获得了相当积极的早期研究数据,并同时按照附条件批准策略开展临床研究。如果药品A率先获得附条件批准上市,由于药品A的确证性研究能否获得成功存在不确定性,其他药品在完成关键性注册研究后仍然可以按照沟通交流中与审评部门达成的共识递交附条件批准申请。
但是如果药品A上市后完成了确证性研究并成功获得常规批准,该适应证人群的现有治疗手段和临床实践便因此发生变化,其附条件批准的适用性或技术要求也会随之改变,按照前期确定的技术要求开展研究并在药品A获常规批准后提出的附条件批准申请很可能会被拒绝,而与药品A作用机制相同的其他药品则将不再符合附条件批准该适应证的适用情形。
2)符合附条件批准的药品与优先审评审批程序
按照现行办法[1],“符合附条件批准的药品”可以申请适用优先审评审批程序。原则上,只有临床研究数据提示明显临床优势的药品才有可能符合附条件批准,通常会被纳入优先审评审批程序。但是,如果已有相同作用机制的药品被附条件批准,后续递交相同适应证附条件批准申请药品的临床价值将被大大降低,因此不能再获得优先审评审批。
3)附条件批准药品与“现有治疗手段”
《药品附条件批准上市技术指导原则(试行)》指出“附条件批准上市的药品,在临床获益未经证实前不作为现有治疗手段”。但该指导原则同时说明“现有治疗手段是指在境内已批准用于治疗相同疾病的药品,或者标准治疗方法等”。临床实践对标准治疗的定义与药品获批适应证不完全一致的现象并不少见,例如: 阿扎胞苷在全球范围内均未被监管机构批准用于骨髓原始细胞≥30%的AML,却已经成为不能接受强化化疗AML患者的标准治疗。
由于一些历史原因,一些附条件批准上市的药品未开展确证性注册研究(如苯达莫司汀用于惰性非霍奇金淋巴瘤),但其临床获益却在临床实践中得到证实且其价值得到广泛认可,甚至成为标准用药方案的一部分,没有理由将这些附条件批准的药品排除在现有治疗手段之外。即使不作为“现有治疗手段”,附条件批准药品的研究结果也构成历史数据的一部分,为相同适应证中其他药品的附条件批准申请提供很好的审评参考。
针对类似情形,欧盟指出: “为证明第二种或后续产品对未满足临床需求的价值时,应考虑前期已获得条件性批准药品所累积的临床数据和其疗效尚未解决的不确定性。由于已获条件批准的药品尚未确认其全部获益,若预期后续产品可与已获条件性批准产品同等程度或更大程度地满足未满足的临床需求,也可获得条件性批准的推荐。”
4)附条件批准药品注册证书有效期及上市后研究完成时限
现行办法没有指定附条件批准药品注册证书的有效期和确证性研究的完成时限,但常规批准药品的证书有效期为5年[1],因此附条件批准药品注册证书的有效期不能长于5年。确证性研究数据补充申请的审评时限为200d[1],因此原则上需要在附条件批准后4年内递交申请。
实际上,敦促持有人在药品附条件批准上市后尽快完成确证性研究,对所有监管机构而言都是一个非常现实的问题,设立有效期是解决方案之一。对美国FDA加速批准和欧盟条件性批准的分析表明,自获批上市至采取后续行动所需时间超过6年的比例分别为21%和27%[12],因此,中国的时限要求将给附条件批准药品带来不小的压力。
美国FDA的数据表明,在获得加速批准时已经启动确证性研究的药品,自批准至完成确证所需的时间明显缩短(3.1vs5.5年)[12],一方面是因为早启动直接带来的时间优势,另一方面是因为在药品获得加速批准后再启动确证性研究,受试者对对照治疗的态度会受到试验药品的预期获益影响而使入组难度增加。
总结
自实施之日起,加快上市注册程序的具体流程和决策标准即广受关注。审评部门作为直接的实践者,力争公开透明,最大程度地发挥加快上市注册程序对鼓励创新的激励作用,更令患者尽早受益于药品创新的成果。
参考文献:
《中国新药杂志》2023年第32卷第2期