您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-27 11:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.信达PI3Kδ抑制剂拟纳入优先审评。信达生物从Incyte公司引进的新一代口服PI3Kδ抑制剂Parsaclisib首次提交NDA申请并获CDE拟纳入优先审评,用于既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。值得一提的是,该适应症此前已被CDE纳入突破性治疗品种名单。一项中国关键II期研究结果显示,在61例复发或难治性FL患者中,Parsaclisib的客观缓解率达86.9%(95%CI : 75.8%-94.2%)。
2.和誉CSF-1R抑制剂获批III期临床。和誉医药CSF-1R抑制剂ABSK021获国家药监局临床默示许可,拟开展评估用于治疗腱鞘巨细胞瘤(TGCT)的关键III期临床。值得一提的是,ABSK021针对该适应症此前已被CDE纳入突破性治疗品种名单。目前,ABSK021已在美国完成Ⅰa期临床剂量爬坡试验并正在中国与美国同步开展Ⅰb期多队列扩展研究。和誉医药计划在CTOS2022年会上公布ⅠB期临床TGCT患者队列的积极数据。
3.原启自体GPRC5D靶向CAR-T获孤儿药资格。原启生物自主研发的自体GPRC5D CAR-T疗法OriCAR-017获FDA授予孤儿药资格, 用于治疗复发/难治性多发性骨髓瘤(R/R MM)。一项I期临床研究数据显示,单次静脉输注OriCAR-017达到100%的客观缓解率,完全缓解/完全缓解率为60%。患者平均观察期为175天(范围:35-281天)。临床中,无剂量限制性毒性或严重不良事件报道,无免疫细胞治疗相关神经毒性综合征报道。
4.启愈SIRPα/PD-L1双抗国内报IND。启愈生物自主研发的1类生物药注射用Q-1801的临床试验申请获CDE受理。这是一款全球首创同时靶向SIRPα及PD-L1的双特异性抗体,今年9月已获得FDA临床许可。Q-1801一方面通过SIRPα抗体阻断SIRPα和CD47结合,消除其抑制效应,且不产生血液毒性;另一方面通过PD-L1抗体阻断PD-L1抑制信号,激活T细胞对肿瘤的特异性杀伤效应。该新药拟开发用于治疗PD-L1表达的肿瘤。
5.亚盛Bcl-2抑制剂报非肿瘤领域IND。亚盛医药宣布,该公司已正式向CDE递交新药临床试验(IND)申请,计划开展在研原创1类新药Bcl-2选择性抑制剂APG-2575治疗系统性红斑狼疮(SLE)的Ib/II期临床,评估APG-2575针对轻中度SLE患者的安全性、药代动力学和药效动力学,以及初步临床疗效。APG-2575此前已在血液肿瘤及实体瘤相关临床研究中展现了良好的耐受性及有效性。
6.舒泰神C5a单抗皮下注射液在美报IND。舒泰神C5a靶向单抗STSA-1002的皮下给药剂型的临床试验申请获FDA受理,拟开发用于抗中性粒细胞胞质抗体(ANCA)相关性血管炎适应症。STSA-1002能够与过敏毒素C5a特异性结合,从而阻断C5a诱导的中性粒细胞趋化与氧呼吸爆发,同时保留补体系统的溶菌功能。此前,STSA-1002注射液已在美国开展用于治疗重型COVID-19的I期临床试验,目前处于项目总结阶段。
国际药讯
1.全球首款BCMA/CD3双抗获批上市。强生旗下杨森BCMA/CD3双特异性抗体teclistamab获FDA批准上市,用于治疗复发或难治性多发性骨髓瘤(r/r MM)。在一项Ⅰ/Ⅱ期临床MajesTEC-1中,teclistamab在既往接受至少三种前期疗法的RRMM患者中达到63%的总缓解率,其中完全缓解(CR)率为39.4%。今年8月,该新药首次获欧盟批准上市,是首款BCMA靶向双抗获批。
2.Aβ寡聚体抗体新药获FDA快速通道认定。Acumen公司靶向Aβ寡聚体(AβOs)的单抗药物ACU193获FDA授予治疗早期阿尔茨海默症(AD)的快速通道资格认定。它通过阻止AβO与树突棘结合来帮助保护神经元功能,进而发挥治疗作用。目前,ACU193正在开展I期INTERCEPT-AD研究,旨在评估其在早期AD患者中的安全性、耐受性和药效药动学,相关数据预计在2023H1得出。
3.阿斯利康公布IL-5Rα单抗食管炎III期研究数据。阿斯利康IL-5Rα单抗benralizumab治疗嗜酸性粒细胞性食管炎(EoE)的III期研究(MESSINA)达到第24周有组织学应答(食管上皮内嗜酸性粒细胞计数≤6 eos/hpf的峰值)的患者比例显著高于安慰剂组的主要终点,但未能达到显著改善患者DSQ指标(吞咽困难症状评分)的另一个主要终点。此外,药物的安全性与此前报道一致。阿斯利康计划日后公布完整的分析数据。
4.家族性胆汁淤积症新药III期临床成功。Mirum公司口服回肠胆汁酸转运体(IBAT)抑制剂maralixibat(马昔巴特)治疗进行性家族性肝内胆汁淤积症(PFIC)广泛亚型患者的III期MARCH研究达到主要终点。在PFIC2亚型患者中,maralixibat较安慰剂显著改善瘙痒程度(p=0.0098);血清胆汁酸水平较基线也显著下降(p=0.0013)。药物的安全性与既往研究一致。北海康成拥有该新药的大中华区独家授权。
5.TREM1抑制剂治疗重症新冠II期研究成功。Inotrem公司TREM1抑制剂Nangibotide在治疗重症COVID-19患者的II期ESSENTIAL研究达到主要终点。与标准治疗相比,该新药对因COVID-19而需要呼吸支持的患者的疾病进展和呼吸衰竭的严重程度以及其在ICU的住院时间产生积极影响,使患者的28天全因死亡率相对降低43%(p= 0.030)。该公司计划与美国和欧盟的监管机构协商,尽快为重症COVID-19患者提供新的治疗方案。
6.艾伯维2.55亿美元现金收购DJS。艾伯维宣布将以2.55亿美元现金收购G蛋白偶联受体(GPCR)药物研发公司DJS Antibodies(简称DJS)。DJS的主要候选产品DJS-002是一种潜在的first-in-class溶血磷脂酸受体1(LPAR1)拮抗剂抗体,目前处于临床前开发,拟用于治疗特发性肺纤维化(IPF)和其他纤维化疾病。艾伯维预计将保留所有的现任DJS员工及其在牛津的工厂。DJS股东仍然有资格获得与DJS-002项目相关的里程碑付款。
医药热点
1.浙大医学院附属儿童医院重启感染科病房。10月24日,浙江大学医学院附属儿童医院滨江院区的感染突发楼扩建升级工程全面竣工并重启感染科病房。改造完成后,感染突发楼共6层,承接发热门诊、感染传染病房、感染ICU等功能,具备CT室、手术室、病原PCR室,拥有30间负压普通病房(72张普通床位和6张特需床位)、4个负压感染ICU病房,成为国内为数不多的具有严格三区两通道的硬件高配置的儿童传染感染科,将为华东地区儿童传染感染性疾病的诊治和管理提供了有力的医疗保障。
2.国家中西医结合医学中心正式启用。10月25日,国家中西医结合医学中心在中日友好医院揭牌,投入运行。未来,该中心将以新型中西整合医学模式理论为指导,整合构建满足患者健康需求和解决中西医协同关键问题的学科群,提升综合医院医疗服务体系、专业人才培养体系、研究与转化体系、系统评价体系和示范推广体系,成为基于中西医协同与融合并具有中国特色“新医学”的实践基地与推广平台。
3.我国猪-猴多器官、多组织同期联合移植成功。由中国科学院院士窦科峰领衔,空军军医大学西京医院肝胆外科等20个学科于10月16日开展、历时14个小时的国际首例六基因编辑猪-猴多器官、多组织同期联合移植手术获得成功。科研人员通过获取1头基因编辑猪的肝脏、心脏、肾脏3个脏器,以及角膜、皮肤、骨骼3个组织,分别为4只受体猴同期实施肝肾联合移植、心脏移植、角膜和皮肤移植、骨骼移植。目前,4只受体猴及移植器官、组织存活良好。
评审动态
2. FDA新药获批情况(北美10月25日)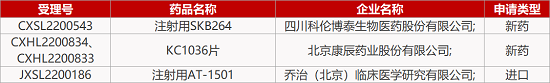
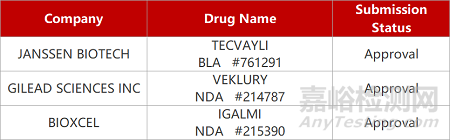

来源:药研发


