您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-13 11:37
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.基石「舒格利单抗」新适应症报产。基石药业PD-L1抗体舒格利单抗第3项适应症上市申请获CDE受理(受理号:CXSS2200077),单药治疗成人复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL)。一项在中美两国同步开展针对R/R ENKTL的注册临床(GEMSTONE-201)中,舒格利单抗经IRRC评估的ORR达到46.2%,其中完全缓解率达到37.2%。此前,FDA 已授予舒格利单抗孤儿药资格和突破性疗法认定。
2.康诺亚ADC拟纳入突破性治疗品种。康诺亚生物1类新药CMG901获CDE拟纳入突破性治疗品种,拟用于经一线及以上治疗失败或不能耐受的Claudin 18.2阳性晚期胃癌的治疗。CMG901由Claudin 18.2特异性抗体、可裂解连接子及毒性载荷一甲基澳瑞他汀E构成。该新药此前已获FDA授予孤儿药资格及快速通道资格,用于治疗复发/难治性胃癌及胃食管结合部腺癌。
3.嘉和CD20/CD3双抗上I/II期临床。嘉和生物CD20/CD3双特异性抗体GB261在中国开展的I/II期临床首例患者给药。该项试验拟用于复发或难治性B细胞非霍奇金淋巴瘤 (B-NHL) 和慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 (CLL/SLL) 患者的治疗。GB261是一款治疗用生物制品1类新药,该新药目前在澳大利亚开展的首次人体临床试验 (FIH) 已显示出初步临床疗效,以及良好的安全性及药代动力学特点。
4.绿叶CD25单抗获批实体瘤临床。绿叶制药旗下博安生物自主开发的1类生物制品BA1106注射液获国家药监局临床默示许可,拟用于实体瘤的治疗。BA1106是一款CD25单抗,旨在通过ADCC(抗体依赖的细胞介导的细胞毒性作用)效应削减肿瘤微环境中的Treg细胞,增加效应T细胞的比例。临床前研究显示:BA1106对于早期和晚期肿瘤模型均有较好的治疗效果,与PD-1抗体联用具有协同抗肿瘤的潜力。
5.诺诚健华BCL2抑制剂获批临床。诺诚健华自主研发的1类化药ICP-248片获国家药监局临床默示许可,拟开发用于治疗恶性血液肿瘤。ICP-248是一种高选择性BCL2抑制剂,可通过与BCL2特异性结合,解除因BCL2过表达所致线粒体凋亡途径的抑制,释放并激活促凋亡蛋白,增加线粒体膜的通透性,并释放细胞色素c;它还可激活caspase介导的凋亡级联反应,恢复和促进肿瘤细胞凋亡,发挥抗肿瘤作用。
6.西湖大学新冠口服药获批临床。西湖大学原创小分子药物WPV01(艾普司韦)获国家药监局批准开展临床。这是一款靶向3CLpro的非共价抑制剂,旨在抑制3CLpro以阻断新冠病毒复制。临床前研究显示,WPV01对不同新冠病毒(SARS-CoV-2)变异株、以及严重急性呼吸道综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)等在内的其它冠状病毒均具有抑制作用。
国际药讯
1.长效肉毒杆菌毒素获FDA批准上市。FDA批准Revance公司新型长效神经调节剂Daxxify(daxibotulinumtoxinA,A型肉毒杆菌毒素)上市,只需一年两针,用于治疗成人的中重度眉间纹。在关键Ⅲ期临床中,有74%的受试者在治疗第4周时,眉间纹改善达到两级以上。中位疗效持续时间为6个月。复星医药子公司复星医药产业拥有该新药的中国独家权益。
2.FDA批准新型“升白”药物上市。Spectrum公司新型长效粒细胞集落刺激因子Rolvedon获FDA批准上市,用于降低发热性中性粒细胞减少症患者的感染风险,这些非髓系癌症患者接受的具有骨髓抑制效应的抗癌药物与临床显著的发热性中性粒细胞减少症发作相关。在用于治疗早期乳腺癌患者化疗诱导所致中性粒细胞减少的两项III期临床中,Rolontis与培非格司亭相比达到非劣效性(NI),缩短严重中性粒细胞减少症持续时间。
3.辉瑞创新双激酶抑制剂报产。辉瑞宣布,口服特异性JAK3/TEC抑制剂ritlecitinib的监管申请已获得FDA和EMA受理,用于治疗12岁以上斑秃患者。在一项Ⅱb/Ⅲ期ALLEGRO临床中,与安慰剂相比,接受30mg或50mg的ritlecitinib治疗达到头皮毛发覆盖面积超过80%的患者比例显著更高。该新药目前也已完成在英国、中国与日本的监管申请,预计明年将获得回复。
4.全球首款蠕形螨睑缘炎新药在美报NDA。Tarsus公司新型滴眼液TP-03(0.25% 洛替拉纳)已向FDA提交新药上市申请(NDA),用于治疗蠕形螨性睑缘炎。这是一种由体表寄生虫蠕形螨感染睑缘引起的慢性炎性反应性疾病。在IIb/III期Saturn-1研究和III期Saturn-2研究的中,两项试验均达到主要终点和所有次要终点,分别有81%和89%患者达到疾病治愈(袖套状分泌物等级<2),而且药物的耐受性良好。联拓生物拥有该新药的中国权益。
5.奥拉帕利两项III期卵巢癌临床积极。阿斯利康和默沙东联合开发的PARR抑制剂奥拉帕利(Lynparza)单药或联合贝伐珠单抗用于一线治疗晚期卵巢癌的两项III期临床(SOLO-1和PAOLA-1)最新结果积极。SOLO-1研究显示,与安慰剂相比,奥拉帕利将死亡风险降低45%(p=0.0004),两组的7年存活率分别为67%和47%。PAOLA-1 研究结果显示,奥拉帕利联合贝伐珠单抗组与对照组(贝伐珠单抗+安慰剂)相比,中位OS提高至56.5个月(vs51.6个月),但不具统计学意义;两组HRD阳性患者5年存活率分别为65.5%和48.4%。
6.创新TCR疗法早期临床积极。Adaptimmune公司靶向MAGE-A4抗原的T细胞受体(TCR)细胞疗法ADP-A2M4CD8,在治疗实体瘤的Ⅰ期临床中获积极结果。在25例接受过多种前期治疗的晚期卵巢癌、尿路上皮癌和头颈癌患者中,单剂ADP-A2M4CD8达到44%的客观缓解率。该公司计划开展Ⅱ期临床,进一步评估ADP-A2M4CD8用于这三种癌症治疗的安全性与有效性。
医药热点
1.国家医保局规范种植牙服务收费。9月8日,国家医保局公布《关于开展口腔种植医疗服务收费和耗材价格专项治理的通知》提出,将按照“诊查检查﹢种植体植入﹢牙冠置入”的医疗服务价格实施整体调控,开展全面覆盖公立和民营医疗机构的口腔种植价格专项治理工作。针对单颗常规种植牙的医疗服务价格,要求三级公立医疗机构整体普遍高于4500元每颗的地区,应采取针对性措施,导入至整体不超过4500元每颗的新区间。
2.美国新冠疫苗“流感化”。据《华尔街日报》报道,美国秋季加强针行动将于9月启动,政府将向各州、药店和疫苗接种站提供1.75亿剂新一代新冠疫苗,民众可以在今年秋季或冬季接种常规流感疫苗的同时,接种新型新冠疫苗。美国国家过敏症和传染病研究所所长、白宫首席医疗顾问安东尼·福奇指出,新型疫苗“一年一打”可以为大部分美国人提供保护,“我们可能正朝着类似于每年接种流感疫苗的道路前进”。
评审动态
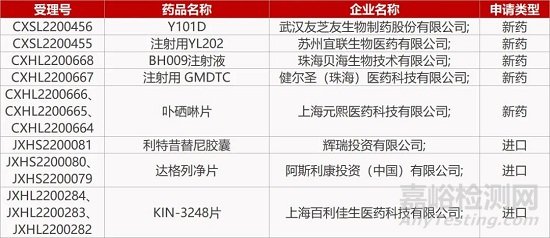
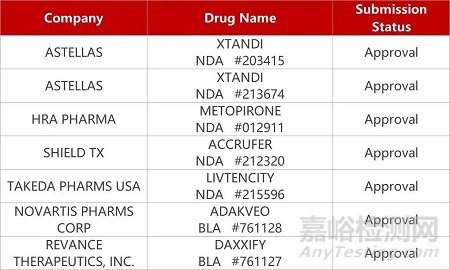
1. CDE新药受理情况(09月12)

来源:药研发


