您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-01 20:40
本文主要介绍了上海捷诺生物科技有限公司研发的医疗器械“人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)”的临床前研发实验。
一、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法) 的产品结构及组成
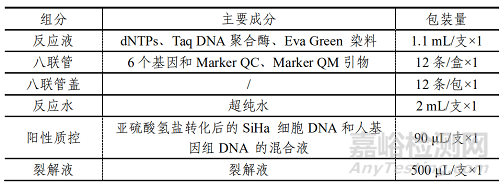
表 1 试剂盒主要组成成分
二、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)产品预期用途
本产品用于体外定性检测人宫颈脱落细胞中 ASTN1、DLX1、ITGA4、RXFP3、SOX17、ZNF671 基因的甲基化状态。
本产品适用于 12 种高危 HPV(hrHPV)基因型(31、33、35、39、45、51、52、56、58、59、66、68 型)检测阳性的 30 岁以上女性人群,帮助识别是否需要进行阴道镜检查,达到分流管理的目的。hrHPV 持续感染是导致宫颈癌的主要病因,但大多数感染是一过性且无临床症状,能够通过自身免疫系统调节而清除,仅有极少数 hrHPV 持续感染的患者可能会进展为宫颈癌前病变甚至宫颈癌。
使用本产品检测,当检测结果为阴性时,提示无宫颈病变或宫颈病变级别较低的可能性较大,可避免阴道镜及组织活检检查,做好定期复查;检测结果为阳性时,提示宫颈病变级别较高的可能性大,需进一步进行阴道镜和/或组织活检检查。该检测不能替代宫颈细胞学检查。
三、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)的产品包装规格
10 人份/盒。
四、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)的产品检验原理
本产品包括三个步骤:细胞裂解、亚硫酸氢盐转化和实时荧光PCR。
步骤 1,细胞裂解:使用试剂盒内的裂解液对宫颈脱落细胞进行裂解,释放基因组 DNA;
步骤 2,亚硫酸氢盐转化:细胞裂解后用亚硫酸氢盐进行转化处理,DNA 上未发生甲基化的胞嘧啶 C 因脱氨基反应变成尿嘧啶 U,而发生甲基化的胞嘧啶 C 则不会被亚硫酸氢盐转化;
步骤 3,实时荧光 PCR:以转化后的 DNA 为模板做荧光 PCR扩增,特异性的引物只能扩增发生甲基化的基因,从而检测 6 个基因 ASTN1(Marker1)、DLX1(Marker2)、ITGA4(Marker3)、RXFP3(Marker4)、SOX17(Marker5)、ZNF671(Marker6)的甲基化状态。
本产品同时设置了内部质控 Marker QC 和 Marker QM,Marker QC 用于评估样本 DNA 是否足量以及亚硫酸氢盐转化质量是否合格,Marker QM 用于评估女性样本的正常甲基化状态。
五、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)主要原材料的选择
本产品的主要原材料包括:产品的主要原材料有引物、Taq DNA聚合酶、dNTPs、Eva Green 染料、SiHa 细胞和裂解液。这些原材料均是通过外购的方式获得。
引物由上海捷诺自行设计,由合成公司经过合成和纯化后获得;Taq DNA 聚合酶由原材料供应商重组表达纯化后获得;dNTPs 由供应商化学合成获得。
上海捷诺对主要原材料进行了供应商的选择,通过功能性实验筛选出合格供应商,制定了各主要原材料的技术要求和质量标准并经检验合格。
六、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)的企业参考品设置情况
该产品企业参考品包括阳性参考品、阴性参考品、精密度参考品、最低检出限参考品,组成如下:
阳性参考品包括 7 种,分别命名为阳性参考品 P1~P7,其中阳性参考品 P1~P3 为一定细胞量下不同甲基化比率的样本;阳性参考品 P4~P5 为不同浓度的 SiHa 细胞;阳性参考品 P6 为人宫颈鳞癌细胞样本;阳性参考品 P7 为人宫颈腺癌细胞样本。
阴性参考品包括 5 种,分别命名为阴性参考品 N1~N5,其中阴性参考品 N1 为 IL-17 基因甲基化的人宫颈脱落细胞;N2 为 STK31基因甲基化的人宫颈脱落细胞;N3 为 DNMT1 基因甲基化的人宫颈脱落细胞;N4 为 IFFO1 基因甲基化的人宫颈脱落细胞;N5 为卵巢癌患者的宫颈脱落细胞。
精密度参考品包括 3 种,分别命名为精密度参考品 C1~C3,其中精密度参考品 C1 为中高甲基化比率的样本;精密度参考品 C2 为低甲基化比率样本;精密度参考品 C3 为 6 个标志物非甲基化的人宫颈脱落细胞样本。
最低检出限参考品包括 6 种,分别命名为最低检出限参考品S1~S6,为经过系列稀释后的 6 个不同甲基化比率的细胞样本。
本试剂盒设置了阳性质控和阴性质控,用于检测过程中试剂盒和仪器的质量控制。此外,每个样本均检测 2 个内部质控,用于结果的判读和评估样本的质量。
七、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)的生产工艺及反应体系研究
上海捷诺对试剂盒反应体系的研究包括引物浓度的确定、PCR 反应液的选择、反应体积的确定、亚硫酸氢盐转化试剂盒的确定等;对PCR 反应条件的研究包括两步法与三步法、退火温度和扩增循环数的优化;对样本的用量以及样本保存时间进行了研究;对基线和阈值的确定。
通过功能性实验,最终确定了最佳的反应体系。上海捷诺根据试剂盒中试剂及组件的主要生产工艺的研究结果,确定了最佳的生产工艺。
八、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)的分析性能评估研究
该产品分析性能评估内容包括准确度、精密度、最低检出限、分析特异性、包容性、亚硫酸氢盐转化试剂盒研究。准确度研究中,上海捷诺分别使用三批次试剂盒对阳性参品和阴性参考品进行检测,检测结果显示阳性参考品符合率、阴性参考品符合率均为 100%。同时使用若干临床样本对试剂盒准确性进行了研究,检测结果与临床金标准诊断方法学(病理学)结果进行比对,得出 CIN2+和 CIN3+的临床灵敏度分别是 83.05%和 89.47%,临床特异性分别是 84.55%和 78.44%。
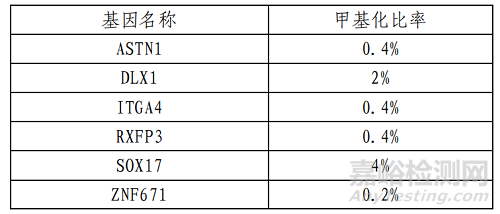
精密度研究通过不同地点、人员、轮次、日间和批次对中强阳性、弱阳性以及阴性样本进行连续 20 天精密度研究,本试剂盒检测结果的 Ct 值变异系数(CV)均不大于 5.0%。最低检出限研究,以阴性宫颈脱落细胞样本为基质,对不同甲
基化比率的模拟样本和临床阳性稀释样本进行检测,得到宫颈脱落细胞样本的检测限,6 个基因的最低检出限如下表:
分析特异性研究包含交叉反应和干扰研究,交叉反应研究结果表明试剂盒检测非目标的其他基因甲基化阳性的宫颈脱落细胞样本,均无交叉反应。
干扰实验研究结果显示,宫颈脱落细胞样本中含有以下干扰物质:500mg/dL 血红蛋白、1×106个/mL 白细胞、宫颈粘液、20mg/mL替硝唑阴道片、174mg/mL 保妇康栓、100mg/mL 重组干扰素 α2b 凝胶、润滑剂,对本试剂盒的检测结果无影响。
包容性研究,上海捷诺对不同宫颈癌组织类型样本的适用性进行研究,对宫颈癌组织类型为鳞癌、腺癌、腺鳞癌样本研究结果表明,本试剂盒适用于不同宫颈癌组织类型。
上海捷诺采用临床宫颈脱落细胞样本进行了亚硫酸氢盐转化试剂盒性能研究,并根据与本试剂盒的组合性能研究结果,确定推荐的亚硫酸氢盐转化试剂盒符合检测要求。
九、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)的阳性判断值或参考区间研究
本产品阳性判断值的研究采用临床来源的宫颈脱落细胞样本。
636 例样本中≤CIN1 病例 503 例,CIN2 病例 85 例,≥CIN3 病例48 例。上海捷诺使用本产品和一代测序分别检测上述样本中 6 个基因的甲基化情况,以一代测序结果为金标准,采用 ROC 曲线法确定每个基因 ΔCt 值的阳性判断值。
以病理结果为金标准,采用逻辑回归分析方法确定模型中 6 个基因的权重,建立 6 个基因的评分,然后根据约登指数最大的原则确定最佳阈值,最终确定本试剂盒的阳性判断值为 3。当 6 个基因分值总和<3 时,样本检测结果为阴性;当 6 个基因分值总和≥3 时,样本检测结果为阳性。
十、人ASTN1、DLX1、ITGA4、RXFP3、SOX17、 ZNF671 基因甲基化检测试剂盒(荧光 PCR 法)的稳定性研究
上海捷诺对本产品的实时稳定性、运输稳定性进行了研究,同时,对样本的稳定性也进行了研究。
实时稳定性:将三批次试剂盒置于 2~8℃条件下保存,在效期的第 0、8、10、12、14 个月各进行一次检测,试剂盒在生产后保存至 14 个月各项性能指标均符合产品技术要求,产品有效期可达 12个月。
此外,上海捷诺对产品的运输稳定性进行了研究。结果显示,产品的性能均满足产品说明书的声称。
样本稳定性:上海捷诺对样本稳定性进行了研究,结果表明样本在室温下保存 4 周内,在 2~8℃保存 12 周内进行检测。常温条件下,样本运输时间不超过 3 天。

来源:嘉峪检测网


