您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-09 11:03
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.江苏瑞科新冠疫苗获菲律宾临床许可。江苏瑞科重组蛋白新冠疫苗ReCOV获菲律宾药监部门临床许可,即将开展II期临床,评估ReCOV与辉瑞mRNA疫苗COMIRNATY®相比,在18周岁或以上已接种两剂灭活新冠疫苗基础免疫的健康受试者的免疫原性和安全性。在临床前研究中,ReCOV可诱导高滴度广谱中和抗体和Th1偏向性T细胞免疫反应,对奥密克戎等变种病毒具有良好的交叉中和作用和免疫持久性。
2.普方FRa靶向ADC获批肿瘤临床。普方生物开发FRα-ADC药物PRO1184获FDA临床许可,拟开展Ⅰ期临床,评估用于晚期癌症(包括卵巢癌、子宫内膜癌、乳腺癌、非小细胞肺癌和间皮瘤)患者的安全性、抗肿瘤活性和药代动力学。公布在AACR2022年会上的临床前研究数据显示,PRO118在几种小鼠CDX模型中显示出良好的肿瘤生长抑制活性和良好的治疗窗口。此次为该新药首次获批临床。
3.葆元ROS1抑制剂获FDA突破性疗法认定。葆元医药ROS1抑制剂他雷替尼获FDA授予突破性疗法认定,用于治疗既往未经ROS1-TKI治疗或既往接受过克唑替尼治疗的晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)成人患者。公布在ASCO2022会议上的TRUST试验数据显示,在ROS1融合阳性、既往未经ROS1-TKI治疗的NSCLC患者中,确认的客观缓解率(cORR)和疾病控制率(DCR)分别92.5%和95.5%。今年2月,该新药已被CDE纳入突破性治疗品种。
4.安立玺荣CSF-1R抑制剂获孤儿药认定。FDA授予安立玺荣CSF-1R抑制剂EI-1071孤儿药资格,用于特发性肺纤维化(IPF)的治疗。CSF-1信号在肺巨噬细胞的调控中起重要作用,巨噬细胞驱动IPF的炎症损伤和组织纤维化。此外,EI-1071还可以抑制阿尔兹海默病临床前模型中脑小胶质细胞介导的神经炎症,该新药目前也正被开发用于治疗阿尔兹海默病。
5.众生口服新冠药早期临床积极。广东众生药业宣布,旗下众生睿创开发的口服抗新冠3CL蛋白酶抑制剂RAY1216已完成Ⅰ期临床试验全部受试者的入组和临床观察。试验结果初步显示,健康人单次口服不同剂量的RAY1216 片具有良好的安全性和耐受性。整个试验过程中,无严重不良事件发生,无严重未预期的不良事件发现,所发生的不良事件均为轻度。
国际药讯
1.拜耳「达罗他胺」新适应症获FDA批准。FDA批准拜耳口服雄激素受体抑制剂(ARi)达罗他胺(darolutamide)的补充新药申请(sNDA),与多西他赛联用治疗转移性激素敏感性前列腺癌(mHSPC)。在Ⅲ期临床ARASENS中,与雄激素剥夺治疗(ADT)+多西他赛相比,达罗他胺联合ADT和多西他赛可显著降低患者的32.5%的死亡风险。详细结果已发表在《新英格兰医学杂志》上。
2.欧盟批准「伊布替尼+维奈克拉」一线治疗CLL。强生旗下杨森BTK抑制剂伊布替尼获欧盟委员会批准新适应症,联合维奈克拉一线治疗慢性淋巴细胞白血病(CLL)。在一项III期临床(GLOW)中,与苯丁酸氮芥+奥妥珠单抗联合治疗相比,伊布替尼+维奈克拉显著提高患者的无进展生存期(p<0.001)。这也是全球首个每日1次、全口服、包含BTK抑制剂的CLL一线治疗方案。
3.辉瑞或将50亿美元收购血液治疗公司GBT。据《华尔街日报》报道,辉瑞正考虑以50亿美元收购Global Blood Therapeutics(GBT)。GBT主打产品Oxbryta (voxelotor)是镰状细胞贫血症(SCD)治疗药物,已获批用于4岁以上SCD儿童和成人患者,该新药2022年第一季度收入为5500万美元。GBT在研产品inclacumab和GBT021601刚刚获FDA授予治疗SCD的孤儿药资格以及罕见儿科疾病认定。Inclacumab是一种新型p选择素抑制剂;GBT601是新一代镰状血红蛋白聚合抑制剂。
4.吉利德超4亿美元扩展免疫疗法管线。吉利德宣布将斥资约4.05亿美元收购MiroBio公司并获得该公司I-ReSToRE发现平台和整个免疫抑制受体激动剂产品组合,包括已进入Ⅰ期临床、靶向免疫抑制受体B淋巴细胞和T淋巴细胞衰减子(BTLA)的选择性激动剂MB272,以及PD-1激动剂MB151等早期项目。I-ReSToRE平台可结合受体图谱数据库和可视化工具Checkpoint Atlas及其抗体工程,有潜力开发针对免疫抑制受体的激动剂抗体,用于自身免疫性疾病的治疗。
5.辉瑞放弃开发心肌病口服小分子。辉瑞宣布终止p38 MAPK口服小分子抑制剂PF-07265803用于治疗MNA扩张型心肌病(DCM)的国际III期临床(REALM-DCM),并放弃其进一步开发。根据该项研究的中期结果分析,试验不太可能达到主要研究终点。详细数据将在未来的医学会议上公布。PF-07265803(ARRY-797)是辉瑞以114亿美元收购Array公司所获。
6.默克2022H1业绩公布。默克公布2022年上半年财务报告,上半年净销售额达107.66亿欧元,同比增长13.3%。产品销售方面,PD-L1抑制剂Bavencio(阿维鲁单抗)上半年收入2.74亿欧元,同比增长84.5%;肿瘤药物Erbitux(西妥昔单抗)第二季度销售额同比下降5.8%,上半年收入5.00亿欧元;用于治疗多发性硬化症(MS)的Mavenclad(克拉屈滨)上半年销售额达到4.01亿欧元,同比增长31.8%。
医药热点
1.北京大学人民医院实施同岗同酬。近日,北京大学人民医院宣布,自2022年8月起,将全面实施临床学生/学员基本奖和绩效奖同岗同酬制度。北京大学人民医院方表示,同岗同酬制度,是覆盖各个方面的同岗同酬,包括基本奖、绩效奖和年终奖。在相同科室的相同岗位上参与临床工作,要收获同等的劳动报酬,这是医院对临床轮转的学生、住院医师、专科医师的真正认同。
2.首个国产新冠口服药价格初定。真实生物7日透露,该公司开发的治疗新冠肺炎的阿兹夫定片价格初定为每瓶不到300元(每瓶35片,每片1mg)。为适应大规模生产需求,真实生物8月2日已启动平顶山生产基地阿兹夫定的制剂生产,未来该品种制剂年产量可达30亿片。阿兹夫定是新型核苷类逆转录酶和辅助蛋白Vif抑制剂,此前已获批用于治疗艾滋病;今年7月,该新药新增新冠肺炎适应症获国家药监局应急附条件批准。
3.我国药敏专委会成立。8月6日,国家卫健委临床抗微生物药物敏感性折点研究和标准制定专家委员会正式成立。首届国家药敏专委会主任委员由北京协和医院检验科主任徐英春担任。国家药敏专委会成立后,将组织国内临床微生物学、临床药理学、临床感染病学等各领域专家,在我国抗微生物药物敏感性体系建立、药物临床评价及合理使用、耐药性监测等领域开展各项研究工作。
评审动态
2. FDA新药获批情况(北美08月05日)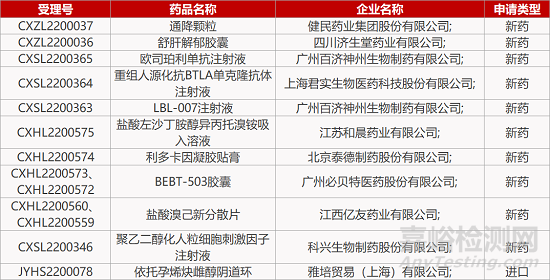
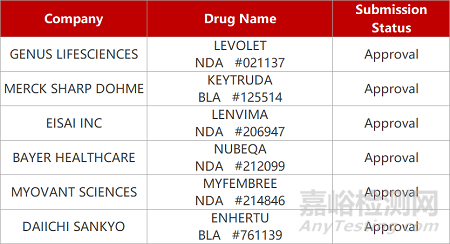

来源:药研发


