您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-10 22:18
车前子是中医常用的利尿通淋药,《中国药典》2020年版车前子项下含量测定要求检测毛蕊花糖苷,且含量不低于0.4%[1]。研究表明车前子中毛蕊花糖苷会受温度、加热时间、pH等影响而发生变化[2-6]。谷彩梅等[2]分析了车前子盐炙品与生品,发现炮制后的车前子中毛蕊花糖苷含量升高,同时盐炙品中异毛蕊花糖苷含量变化显著。田伟等[3]发现车前子中的毛蕊花糖苷和异毛蕊花糖苷含量随煎煮时间、温度、pH值的变化发生一定程度的变化,推测毛蕊花糖苷可能发生酯键断裂生成咖啡酸,并部分转化为异毛蕊花糖苷。本实验以毛蕊花糖苷为研究对象,深入研究pH对毛蕊花糖苷稳定性的影响,明确其变化规律及可能的转化机制。
毛蕊花糖苷是车前子中主要的苯乙醇苷类化合物,其化学结构见图1,为连接咖啡酰基的苯乙醇二糖苷。现代药理研究表明,毛蕊花糖苷具有神经保护作用,能修复阿尔茨海默病的受损神经元,改善学习和记忆功能[7-9];能通过抑制间质表皮转化因子(c-mesenchymal epithelial transition factor,c-Met)的表达进而抑制胶质母细胞瘤细胞的增殖、迁移和侵袭起到杀死肿瘤的作用[10];此外毛蕊花糖苷还具有抗炎[11]、抗氧化[12]、抗病原微生物[13]等作用。毛蕊花糖苷在植物中广泛存在,其毒性小、生物活性多样,因而具有良好的开发和应用前景。但毛蕊花糖苷结构中存在多个酚羟基,易被氧化,化学稳定性较差,限制了它的临床应用。为了进一步探索毛蕊花糖苷的降解特征和降解途径,本研究采用高效液相色谱-紫外(HPLC-UV)和高分辨质谱(HPLC-IT-TOF-MS)技术分析了毛蕊花糖苷在不同pH溶液中加热降解速率,并鉴定了降解产物,初步阐明了其降解规律。
1、材料与仪器
1.1仪器
Prominence型超快速高效液相色谱离子阱飞行时间质谱联用仪(包括LC-20AD型二元泵,SLI-20AC型自动进样器,CTO-20A型柱温箱,SPD-M20A型二极管阵列检测器,日本岛津公司),安捷伦1100型高效液相色谱仪(美国安捷伦公司),XS205DU型电子分析天平(瑞士梅特勒-托利多公司),ST16R型冷冻离心机(美国赛默飞世尔公司),Milli-Q型超纯水系统(美国密理博公司),KQ-500DV超声波清洗器(昆山市超声仪器有限公司),SevenEasy S20 pH计(瑞士梅特勒-托利多公司)。
1.2药品与试剂
毛蕊花糖苷(成都普菲德生物技术有限公司,批号19082201,质量分数99.2%)、异毛蕊花糖苷(四川省维克奇生物科技有限公司,批号wkq20050603,质量分数92.3%)、磷酸二氢钾(天津市风船化学试剂科技有限公司,批号20190904,分析纯)、无水磷酸氢二钠(天津市威晨化学试剂科贸有限公司,批号20140411,分析纯)、冰乙酸(天津市致远化学试剂有限公司,批号20200301,色谱纯)、甲醇(默克公司)、实验用水为Milli-Q型超纯水系统制备超纯水。
2、方法与结果
2.1色谱条件[1]
Agilent ZORBAX Eclipse XDB C18色谱柱(150mm×4.6mm,5 μm);流动相为0.5%醋酸水溶液(A)-甲醇(B),梯度洗脱(0~1 min,5%B;1~40min,5%~60%B;40~50min,5%B);检测波长为254nm,进样量为10μL,柱温为30℃,体积流量为1mL/min。
2.2质谱条件
采用电喷雾电离离子源(ESI),正离子模式扫描,正离子模式下喷雾电压设定为4.5kV,一级、二级离子扫描范围均为m/z100~800,采用三氟乙酸钠作为校正液,雾化气为氮气,体积流量为1.5mL/min,碰撞诱导解离能量50%;曲型脱溶剂管温度200℃,离子累积时间为30ms,检测器电压1.75 kV。
2.3溶液配制
2.3.1毛蕊花糖苷对照品溶液。称取毛蕊花糖苷对照品适量,精密称定,置于棕色量瓶中,加20%甲醇水溶解,并定容至刻度,摇匀,制成0.2mg/mL的对照品溶液。
2.3.2异毛蕊化糖苷对照品溶液。称取异毛蕊花糖苷对照品适量,精密称定,置于棕色量瓶中,加20%甲醇水溶解,并定容至刻度,摇匀,制成0.2mg/mL的对照品溶液。
2.3.3磷酸缓冲液。分别称取磷酸二氢钾和磷酸氢二钠适量,以水为溶剂,配制pH5、6、7的磷酸缓冲溶液。
2.4毛蕊花糖苷降解实验
精密量取“2.3.1”项毛蕊花糖苷对照品溶液,分别与pH5、6、7磷酸缓冲液混匀(2∶1),振荡摇匀后于沸水浴中反应,按0、30、60、90、120、150、180、210、240、300min时间点取样,每个时间点取反应液500μL于1.5mL离心管中,离心(12000r/min,10min),取上清液于2 mL棕色液相小瓶中。
2.5毛蕊花糖苷降解规律分析
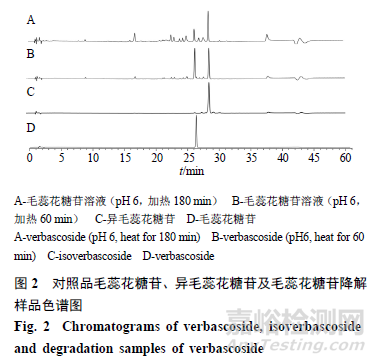
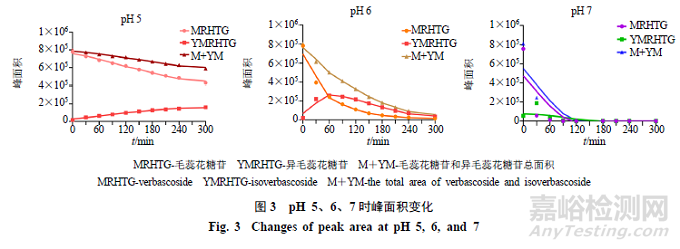
对“2.3.1”项对照品溶液和“2.3.2”项样品,采用HPLC技术进行分析,色谱图见图2。以取样时间为横坐标,每个取样点的峰面积为纵坐标,绘制其在加热过程中变化规律,见图3。从图3可见,pH值越高,毛蕊花糖苷降解速度越快。其中pH5时毛蕊花糖苷降解缓慢,pH7在90min时毛蕊花糖苷几乎全部降解;异毛蕊花糖苷在pH5时,其含量呈升高趋势,随pH升高后,其含量先升高后降低,说明毛蕊花糖苷和异毛蕊花糖苷在接近中性的水溶液中容易降解,毛蕊花糖苷和异毛蕊花糖苷适合在低pH条件下保存。在不同pH条件下,毛蕊花糖苷和异毛蕊花糖苷二者总含量均在降低,推测毛蕊花糖苷在降解过程中,生成异毛蕊花糖苷和其他降解产物,异毛蕊花糖苷在较高pH值还会继续降解成其他产物。
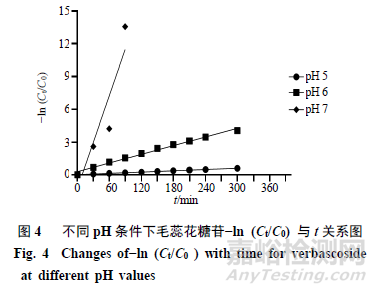
图片pH5、6、7条件下毛蕊花糖苷的降解动力学拟合见图4。毛蕊花糖苷在pH 5时降解方程为y=0.002x+0.0054,R2=0.9991;在pH6时降解方程为y=0.013x+0.28,R2=0.9883;在pH7时降解方程为y=0.1826x+0.327,R2=0.8651;毛蕊花糖苷−ln(Ct/C0)与t的关系函数斜率即pH 5、6、7中毛蕊花糖苷的反应速率常数k呈增长趋势,且pH5、6中毛蕊花糖苷−ln(Ct/C0)与t的线性相关系数(R2)均接近1,可见相关性很好,降解反应属于一级反应;pH7降解速率较快,数据较少,R2为0.8651。pH5、6、7条件下毛蕊花糖苷的降解半衰期分别为346.5、51.9、3.73min。随pH值增加,毛蕊花糖苷的降解反应速率增大,半衰期减小。通过分析毛蕊花糖苷在不同pH条件下降解反应常数及其半衰期,提示在低pH条件下毛蕊花糖苷稳定下较好,适合在低pH条件下保存。
2.6降解产物的HPLC-IT-TOF-MS鉴定
对“2.3.1”项对照品溶液和“2.3.2”项样品,采用HPLC-IT-TOF-MS技术进行分析。典型样品的总体离子流图见图5,根据色谱峰保留时间、质荷比及裂解规律信息推断化合物结构。毛蕊花糖苷降解产物的HPLC-IT-TOF-MS信息见表1。
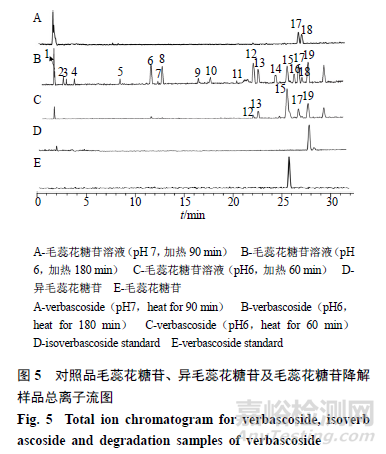
2.6.1毛蕊花糖苷原形。峰15,保留时间为26.245min,其准分子离子峰为m/z642.2381[M+NH4]+,推测的分子式为C29H36O15,误差为−2.6×10−6,峰15与毛蕊花糖苷和异毛蕊花糖苷相对分子质量相同;在MSE质谱图中,主要碎片有脱去1羟基酪醇(C8H10O3,154)的碎片m/z471.1515 [M+H-NH4-C8H10O3]+以及脱去1鼠李糖基的(C6H10O4,146)碎片m/z325.0918[M+H-C8H10O3-C6H10O4]+,可能的裂解规律见图6。通过与毛蕊花糖苷对照品比对,鉴定峰15为毛蕊花糖苷。
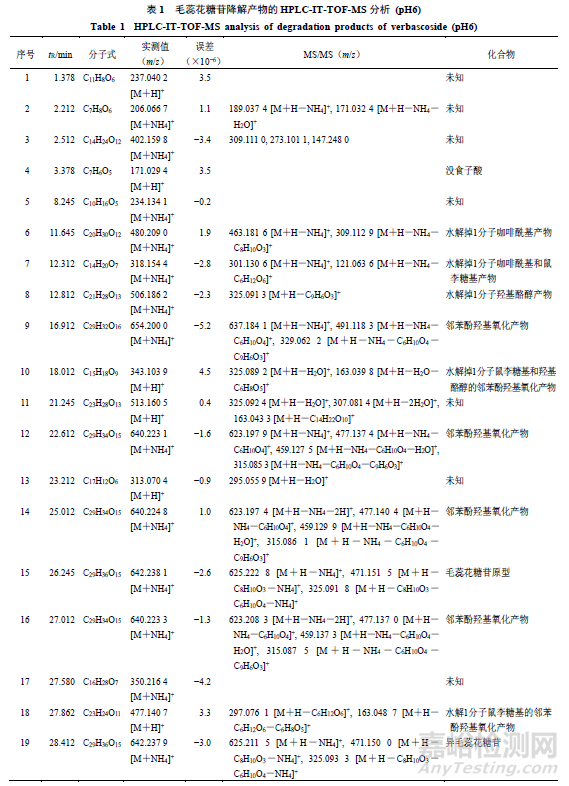
2.6.2异构化产物。峰19,保留时间为28.412min,其准分子离子峰为m/z642.2379[M+NH4]+,推测的分子式为C29H36O15,误差为−3.0×10−6,峰19与毛蕊花糖苷和异毛蕊花糖苷相对分子质量相同;在MSE质谱图中,主要碎片离子m/z625.2115[M+H]+,m/z471.1500[M+H-C8H10O3]+,m/z325.0933[M+H-C8H10O3-C6H10O4]+,同峰15的裂解规律相同,通过与异毛蕊花糖苷对照品比对,鉴定峰19为异毛蕊花糖苷。
2.6.3水解产物。毛蕊花糖苷在加热过程中发生水解反应,可能水解掉咖啡酰基、鼠李糖基、羟基酪醇等结构,水解产物包括峰6、7、8。
峰6,保留时间为11.645min,准分子离子峰为m/z480.2090[M+NH4]+,推测的分子式为C20H30O12,误差为1.9×10−6,峰6相对于毛蕊花糖苷和异毛蕊花糖苷少了1咖啡酰基(C9H6O3,162)碎片;在MSE质谱图中,可见脱去一羟基酪醇(C8H10O3,154)产生的碎片m/z309.1129 [M+H-C8H10O3-NH4]+,通过质谱数据推断峰6为毛蕊花糖苷或异毛蕊花糖苷水解掉一咖啡酰基(C9H6O3,162)的产物,其可能的裂解规律见图7。
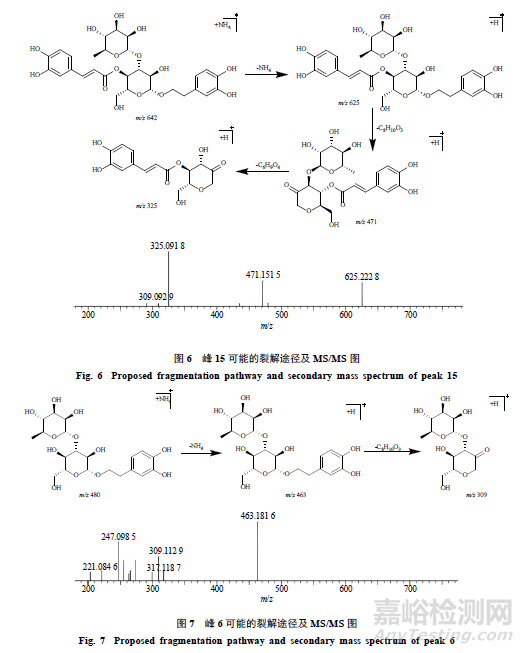
峰8,保留时间为12.812min,准分子离子峰为m/z506.1846[M+NH4]+,推测的分子式为C21H28O13,误差为−2.3×10−6,峰8相对于毛蕊花糖苷和异毛蕊花糖苷少了1羟基酪醇(C8H10O3,154)碎片;在MSE质谱图中,可见脱去1咖啡酰基(C9H6O3,162)产生的碎片m/z325.0907[M+H-C9H6O3]+,通过质谱数据推断峰8为毛蕊花糖苷或异毛蕊花糖苷水解掉1羟基酪醇(C8H10O3,154)的产物,其可能的裂解规律见图8。毛蕊花糖苷在加热过程中生成的水解产物还包括峰7、10、18,其可能的结构见图9。
2.6.4氧化产物。研究[14-15]表明,邻苯酚类化合物在过量氧存在时会发生自氧化,生成相应的半醌或醌类化合物。毛蕊花糖苷和异毛蕊花糖苷结构中均有2个邻苯酚存在,在过量氧存在时,发生自氧化。由于结构中邻苯酚位置不同,因此氧化产物不同,分别为峰9、10、12、14、16和18。
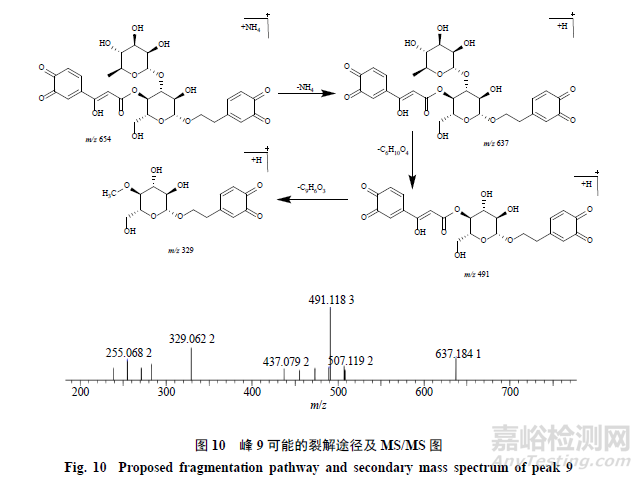
峰9,保留时间为16.912min,准分子离子峰为m/z654.2008[M+NH4]+,推测的分子式为C29H32O16,误差为−5.2×10−6,峰9相对于毛蕊花糖苷和异毛蕊花糖苷少了4个H(4H)、加了1羟基(OH)碎片;在MSE质谱图中,可见脱去1鼠李糖基(C6H10O4,146)产生的碎片m/z491.1183[M+H-NH4-C6H10O4]+,再脱去1咖啡酰基(C9H6O3,162)产生的碎片m/z329.0622[M+H-NH4-C6H10O4-C9H6O3]+,通过质谱数据推断峰9为毛蕊花糖苷或异毛蕊花糖苷2个邻苯酚羟基均被氧化的产物,其可能的裂解规律见图10。
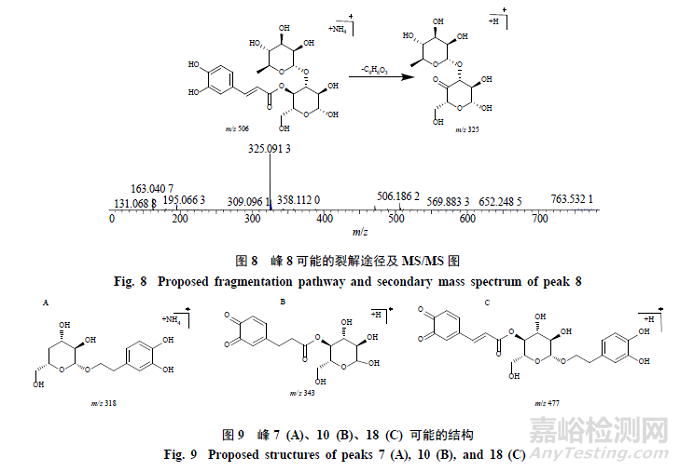
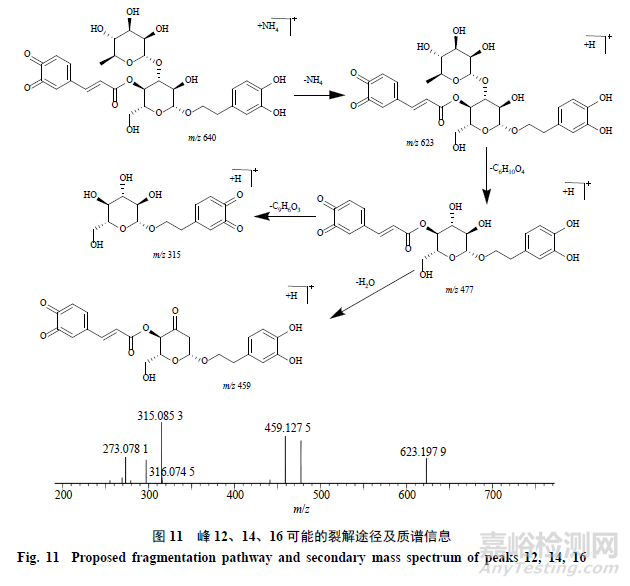
峰12,保留时间为22.612min,准分子离子峰为m/z640.2231[M+NH4]+,推测的分子式为C29H34O15,误差为−1.6×10−6,峰12相对于毛蕊花糖苷和异毛蕊花糖苷少了2个H(2H)碎片;在MSE质谱图中,可见脱去1鼠李糖基(C6H10O4,146)产生的碎片m/z477.1374[M+H-NH4-C6H10O4]+,再脱去1咖啡酰基(C9H6O3,162)产生的碎片离子为m/z315.0853[M+H-NH4-C6H10O4-H2O-C9H6O3]+,通过质谱数据推断峰初步推测峰12为毛蕊花糖苷或异毛蕊花糖苷邻苯酚羟基被氧化的产物;峰12、14和16有相同碎片和裂解规律,推测三者可能是同分异构体,其可能的裂解途径见图11。
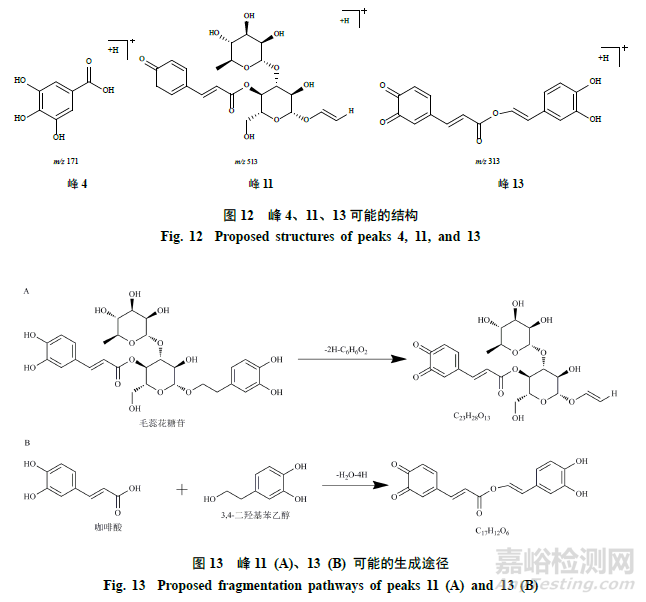
2.6.5其他类。毛蕊花糖苷在加热过程中发生水解、氧化反应,还可能发生聚合、还原等其他反应。峰4准分子离子峰为m/z171.0294[M+H]+,推测的分子式为C7H6O5,通过质谱数据推断及参考文献报道[16],鉴定峰4为没食子酸。图12为推测峰4、11、13可能的结构。
峰11,保留时间为21.245min,准分子离子峰为m/z513.1605[M+H]+,误差为0.4×10−6,推测峰11可能是由毛蕊花糖苷结构中邻苯酚羟基发生氧化,再失去1苯二酚(C6H6O2,110)产生的化合物C23H28O13。峰13,保留时间为23.212min,准分子离子峰为313.0704[M+H]+,误差为−0.9×10−6,推测峰13可能是由碎片咖啡酸(C9H8O4,180)和羟基酪醇(C8H10O3,154)结合生成的化合物C17H12O6。图13为峰11、13可能的生成途径。
3、讨论
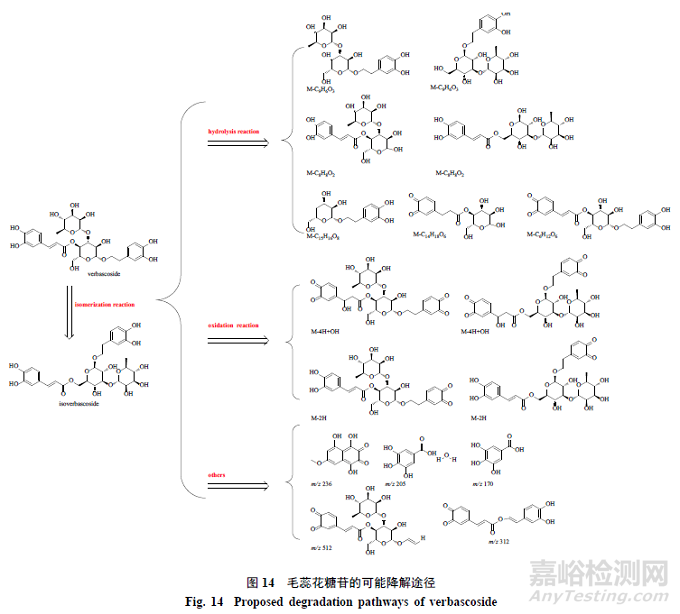
多酚中特殊的多酚羟基结构,尤其是邻位酚羟基,在碱性条件下容易氧化,使多酚的应用受到了很大的限制[17-18]。毛蕊花糖苷结构中存在4个酚羟基,在不同pH条件下,毛蕊花糖苷存在不同程度的降解。在弱酸性条件下,毛蕊花糖苷溶液降解缓慢;在pH7条件下其降解加快,且在90min时几乎全部降解。Zhou等[19]研究表明在常温条件下,毛蕊花糖苷水溶液在pH5条件下比在pH9条件下稳定,降解速率慢,高pH降解速率加快。此研究结论与本研究结果一致,但本研究还鉴定了其降解产物,并对降解途径做了系统的推测,见图14。毛蕊化糖苷降解可能的途径包括异构、水解、氧化等。研究结果显示,毛蕊花糖苷可部分降解为异毛蕊花糖苷,毛蕊花糖苷与生成的异毛蕊花糖苷继续发生水解及氧化等降解反应,异毛蕊花糖苷含量在pH较高时呈先升高再降低趋势,水解与氧化降解的比例随pH升高增加。
田伟等[3]的研究显示,车前子煎煮过程中毛蕊花糖苷含量呈现先增加后降低的变化趋势,且随时间的增加,其含量继续降低,异毛蕊花糖苷含量在煎煮过程中呈增加的趋势。本研究前期对车前子水煎液的pH进行了测定,其pH值为6.2,介于本试验考察的pH6与7条件之间,推测车前子水煎液中毛蕊花糖苷的变化规律可能与本研究结果相似。毛蕊花糖苷的降解产物可能在车前子水煎液存在并发挥药效,提示应关注车前子、地黄、肉苁蓉等含毛蕊花糖苷药材的煎液中毛蕊花糖苷的降解产物。
本研究结果显示毛蕊花糖苷在弱酸性条件向异毛蕊花糖苷转化,且转化率较高。现代药理研究表明,毛蕊花糖苷与异毛蕊花糖苷可以增强树突状细胞的增殖,具有免疫调节作用[20];毛蕊花糖苷具有神经保护作用[9],异毛蕊花糖苷可能通过上调神经型尼古丁受体亚单位蛋白来发挥神经保护作用[21],毛蕊花糖苷与异毛蕊花糖苷均具有抗氧化作用[22];毛蕊花糖苷与异毛蕊花糖苷具有相似的药理活性,因此建议开展毛蕊花糖苷与异毛蕊花糖苷相关药效等效性试验,明确二者药效关系。
本研究探讨了影响毛蕊花糖苷稳定性的因素并对其降解产物进行分析,为毛蕊花糖苷提取、纯化及车前子、地黄、肉苁蓉等富含毛蕊花糖苷的中药的质量控制提供了参考。

来源:Internet


