您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-24 16:19
FDA正在试行环氧乙烷灭菌主文档试行计划,即,Ethylene Oxide Sterilization Master File Pilot Program,这个计划的目的是:帮助确保患者能够获得安全的医疗器械,并鼓励采用新的创新方法对医疗器械进行灭菌(确定新的灭菌方法和技术,或减少环氧乙烷排放),以减少EtO对环境和公共健康的潜在影响。这个计划在2019年已开始试行于PMA持有者,目前正在考虑扩展至510(k)持有者和合同灭菌商。
这个计划适用的对象,以及试点计划的执行方式如下:
1. 510(k)持有者和合同灭菌商:
使用Established Category B or Novel Sterilization Method进行灭菌的灭菌供应商。当其510(k)cleared的医疗器械发生灭菌变更时,可以考虑灭菌主文件试点计划。
FDA正在考虑的510(k)灭菌变更主文件试点计划,将向所有当前的510(k)持有人开放(暂时还未开放,以什么形式开放也未知),旨在帮助将已cleared的医疗器械的灭菌方法从固定室EtO灭菌循环(fixed chamber EtO sterilization cycle)更改为主文件中描述的灭菌方法(暂时还不知道具体是什么方法)。对于灭菌变更,医疗器械制造商可以引用主文件,而不用提交新的510(k)。
FDA指南Submission and Review of Sterility Information in Premarket Notification (510(k)) Submissions for Devices Labeled as Sterile中对Established Category B or Novel Sterilization Method的定义如下:
Established Category B Method:已建立的方法,没有FDA认可的专门共识标准,但有关于开发、确认和常规控制的公开信息。在FDA以前已经使用离散循环参数评估特定灭菌器的灭菌开发和确认数据,并确定确认方法是足够时,FDA认为这些是Established Category B。
Established Category B灭菌方法的示例:
过氧化氢(H2O2),臭氧(O3),柔性袋系统(例如,柔性袋系统中的EO、扩散法、注射法)
Novel Sterilization Method:新开发的方法,几乎没有或没有公开的信息,没有通过FDA cleared的510(k)或经批准的PMA对灭菌开发和确认数据进行FDA综合评估的历史,也没有FDA认可的专用共识的开发、确认和常规控制。Novel Sterilization Method是一种FDA尚未审查并确定足以对设备进行有效灭菌的方法。具体而言,包括以下四种情况:
1)使用之前未经FDA cleared或批准的化学品作为化学灭菌剂;
2)在科学文献中未被确定为化学灭菌剂的灭菌方法;
3)使用化学品组合的灭菌方法,且该组合之前未经FDA cleared或批准作为灭菌剂,即使组合中的单个化学品之前已被单独cleared或批准作为化学灭菌剂,也将被视为新颖的灭菌方法。
4)该工艺似乎未经FDA评估,有两种情况:一种是,FDA cleared的灭菌器的参数已被更改;另一种是,在之前cleared或批准的提交文件中未对工艺确认数据进行评估但是认为其充分的。这两种情形都将被视为新颖的灭菌方法。
Novel Sterilization Method示例:汽化过氧乙酸,高强度光或脉冲光,微波辐射,声波,紫外线
2. PMA持有者:
2019年11月25日,FDA宣布了针对PMA持有者的EtO灭菌主文件试点计划。该自愿计划旨在,允许使用固定室EtO对一次性医疗器械进行灭菌的公司,在灭菌过程和使用降低EtO浓度的设施之间进行某些更改时提交主文件。
根据该自愿计划,III类医疗器械的PMA持有人可以在post approval report中引用其灭菌提供者提交的主文件,而不是提交PMA supplement。
针对PMA持有者的EtO灭菌主文件试点计划包括以下参与者:
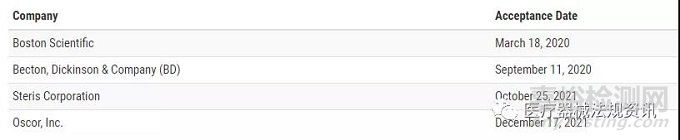

来源:医疗器械法规资讯