您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-02 13:34
前言 验证是老生常谈的一个话题,对于已经验证过的系统,分析方法,工艺是否需要再验证,多长时间验证或基于什么情况下再验证?本文针对公共系统,计算机系统和分析方法总结了各法规的针对再验证提出的相关建议。
质量风险管理方式的应用贯穿药品的整个生命周期。作为质量风险管理系统的一部分,验证及确认范围和程度的决定应基于经过证明的、文件记录的设施、设备、公用工程于工艺的风险评估。既然验证算是风险管理的一部分并且应该贯穿药品的整个生命周期,那么哪些部分需要验证呢?基于WHO的要求,验证包括公共系统验证(水系统、HVAC系统),分析方法验证、清洁验证、工艺验证、计算机系统验证以及设备的确认。而欧盟GMP针对包装和运输也提出了需要验证。有人会问,验证和确认到底有什么关系或者有何区别呢?其实验证和确认本质上是一个概念,确认一般针对设备,仪器和系统而言,而验证一般针对工艺或生产过程。就字面的解释来看,确认是验证的一部分,并且确认应该在验证实施前完成。
正如WHO指南中所述:
Relationship between validation and qualification
Validation and qualification are essentially components of the same concept. The term qualification is normally used for equipment, utilities and systems, and validation for processes. In this sense, qualification is part of validation.
WHO指南认为应针对新厂房,设备,设施和系统,以及新建立的工艺和规程,或者出现重大变更时应进行验证。那么已经过验证的公共设施,系统,分析方法,工艺等,是否还需要再验证?多长时间验证?何种情况下验证?本文针对上述问题,总结了各法规中针对HVAC, 水系统,计算机系统以及分析方法建议的验证周期以及需要再验证的情况。
1 HVAC系统验证
针对HVAC系统,WHO在2011年出台了TRS961文件用来代替原来发布的TRS937文件,在TRS937文件中, WHO建议对HVAC系统每年进行验证,验证的内容包括温度,相对湿度,送风量,回风量或排气量,换气速度,压差,单向流速度,粒子计数等指标,而对于房间粒子计数,建议每半年验证一次。而TRS961文件中建议的验证周期删除了,表明测试周期应该基于在风险评估的基础上由生产商定夺,并且建议当影响到该系统性能的变更出现时应该进行再验证。WHO于 2018年最新发布的TRS 1010文件中建议应基于风险,设施类型,产品,以及变更的范围和影响等方面考虑再验证的实施,该文件还未取代TRS961文件,小编认为原来建议的验证周期还是有一定参考价值的。
新旧文件对比
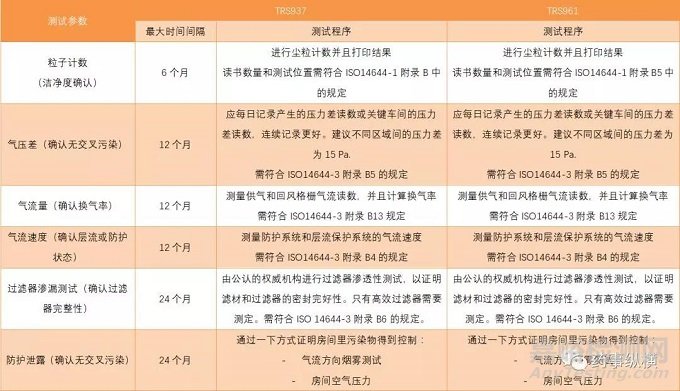

2水系统验证
WHO出台的TRS970 针对WPU验证要求,将制药用水分为BPW, BHPW和BWFI等不同类别的水质,并且较最开始的文件收窄了对水系统的验证周期,要求在第一阶段时,每天连续对饮用水连续采样持续2周以监测其水质。第二阶段在第一阶段得到满意结果的条件下,继续采样2周,如果检测结果仍能达到既定标准,则该水可以用作FPP的生产。第三阶段是基于第二阶段检测结果满意的条件下,水系统运行一年再检测。在第三阶段检测结果仍满意的条件下,WHO建议对水系统应采取系统性回顾,包括如对水机产水,总送水点,总回水点,用水点水质进行趋势分析,并制定警戒限和行动限,如果出现趋势变差或水质不合格,应查找原因并采取相应的措施,同时评估是否需要再验证。在这个持续系统监测的过程中应该使用在线监测设备,以对检测流量(能推测出末端流速),压力,温度,电导率,TOC等参数进行监测,相应的,在线监测的指标也能反映出设备是否出现问题,通过评估确认是否需要维护或需要更换部件,或需要再验证。
3计算机系统验证
当计算机系统有变更时,OMCL 建议对于该系统软件进行评估以确定是否需要再验证,同时要考虑到再验证的范围,因为该变更可能不仅仅影响的是单一的计算机,也可能影响到整个计算机控制系统。同样,如果计算机环境发生变化并对软件的运行造成影响时,计算机系统软件建议被再验证。对于专业版/定制版计算机系统,OMCL建议对软硬件配置每6个月进行定期回顾或者在变更完成后进行回顾。WHO在2018年5月出台了针对计算机系统验证指南的征求意见稿。文件中未对计算机系统有明确的对于周期性验证的建议。它建议周期性回顾计算机系统并且根据回顾结果评估是否需要再验证,并且再验证的范围和内容应该基于风险评估。
4分析方法验证
对于分析方法验证,WHO和ICH建议出现以下情况时进行确认或再验证,如当原料药合成路线发生变化时(可能引入新的杂质,副产物或降解产物,或是引入新的溶剂),制剂的组成发生变化时,使用的分析方法发生变化时,或使用的分析方法从一个实验室转移到另一个实验室时,或主要设备发生变化时等,需要对分析方法进行确认或再验证。FDA针对分析方法验证建议定期对方法进行趋势分析以评估是否需要优化方法或者对整个方法或部分方法进行再验证。当分析方法变化时,或者使用一个新的分析方法,或者分析方法转移时,要考虑进行分析方法验证。FDA指出如果分析方法只能满足系统适用性条件而在操作时按照分析方法的操作条件要进行反复的调试,那么这个分析方法建议被重新评价,验证或修正。
从以上分析来看,对设施设备、分析方法等经过确认或验证过的风险控制状态的进行定期评估是非常有必要的,这种定期评估可以确保其风险控制处于有效的状态,从而确保风险能够在生命周期内得到控制。经过最初的关键性评估和定期的评估后,必要情况下需要对关键的工艺和操作进行定期再验证或再确认。
注:由于小编也努力追逐法规不断变化的脚步,所以如果法规没有及时更新到或解读不全面,尽请谅解。
【1】欧盟GMP/GDP,annex 15 – qualification and validation (revision 1):
general: a quality risk management approach should be applied throughout the lifecycle of a medicinal product. As part of a quality risk management system, decisions on the scope and extent of validation and qualification should be based on a justified and documented risk assessment of the facilities, equipment, utilities and processes.
【2】WHO: Annex 2- Supplementary guidelines on good manufacturing practices for heating, ventilation and air-conditioning systems for non-sterile pharmaceutical dosage forms, TRS937, 2006.
【3】WHO: Annex 5- Supplementary guidelines on good manufacturing practices for heating, ventilation and air-conditioning systems for non-sterile pharmaceutical dosage forms, TRS961, 2011.
【4】WHO expert committee on specifications for pharmaceutical preparations, TRS1010.
【5】WHO:Annex 2 WHO good manufacturing practices: water for pharmaceutical use1
【6】OMCL:Validation of computerized systems core document
【7】OMCL:Validation of computerized systems core document – Annex 1
【8】WHO: Annex 4- Supplementary guidelines on good manufacturing practices: validation
【9】ICH Q2(R1)-Validation of analytical procedures: text and methodology
【10】 FDA:Analytical procedures and methods validation for drugs and biologics
【11】WHO: Guidelines on validation- Appendix 5 Validation of computerized system (May 2018)

来源:Internet


