您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-10 10:46
今日头条
安进PDE4抑制剂即将在华获批上市。安进阿普斯特片(apremilast,商品名:Otezla)的新药上市申请审评状态已更新为「在审批」,预计即将获批上市,用于治疗银屑病。阿普斯特是一款小分子PDE-4抑制剂,已在美国获批用于治疗活动性银屑病关节炎、中重度斑块型银屑病和贝赫切特综合征(Behcet)相关的口腔溃疡。此前,CDE已将阿普斯特片列入第一批临床急需境外新药名单。
国内药讯
1.田边三菱 「替格列汀片」获批上市。田边三菱进口新药替格列汀获国家药监局批准上市。替格列汀(Teneligliptin,TENELIA®) 是田边三菱原研的一款DPP-4抑制剂类糖尿病药物,2012年首次在日本上市,并逐步在韩国等国家上市,用于改善2型糖尿病患者的血糖控制。目前,国内仅原研田边三菱申报;科伦药业曾提交3类仿制药上市申请,但最终获批临床,尚未再次提交。
2.歌礼ASC40治疗痤疮II期临床获批。歌礼制药1类新药ASC40获国家药监局临床试验默示许可,即将开展治疗中、重度痤疮患者的II期临床试验。该项研究计划入组约180例患者,以1:1:1:1的比例随机分配进入各队列组(安慰剂、25 mg、50 mg、75 mg),评估各剂量组治疗的安全性和有效性。ASC40还有两个获批开展临床试验的适应症,分别为非酒精性脂肪性肝炎和复发性胶质母细胞瘤。
3.维托拉生注射液拟纳入优先审评。泰格医药维托拉生注射液的上市申请获CDE拟纳入优先审评,拟定适应症为:肌营养蛋白的基因缺失经验明可通过53号外显子跳跃治疗的杜氏肌营养不良。维托拉生是日本新药株式会社开发的一种反义寡核苷酸,可以靶向肌营养不良蛋白前体mRNA。该新药已于2020年3月获日本PMDA批准上市,8月获FDA批准上市,用于治疗杜氏肌营养不良。
4.和黄医药拿下EZH2抑制剂开发权。和黄医药与Epizyme公司就Epizyme创新EZH2抑制剂TAZVERIK®达成研发和许可协议。TAZVERIK®目前已获FDA批准用于治疗某些上皮样肉瘤(ES)患者和某些滤泡性淋巴瘤(FL)的患者。根据协议,和黄医药将负责TAZVERIK®在大中华区的开发及商业化。Epizyme将获得2,500万美元的首付款,可能不超过1.1亿美元的开发和监管里程碑付款(涵盖最多八个其他潜在适应症)以及额外不超过1.75亿美元的销售里程碑付款。
5.德琪将联手AI药物研发平台。德琪医药与AI药物研发公司德睿智药宣布,将针对难成药靶点联合开发小分子抗肿瘤首创新药。德睿智药将使用其特有的一站式AI药物研发平台Molecule Pro™和分子动力学平台Molecule Dance™,辅助德琪医药设计并获得更多具有“同类首款(first-in-class)”和“同类最优(best-in-class)”潜力的候选药物。此项合作旨在提高当前药物研发效率与成功率。
6.百济神州半年报公布。百济神州公布二季度业绩。2021年第二季度百济的产品收入约9亿元(+111%),上半年产品总收入达到15.8亿元(+108%)。重点产品PD-1替雷利珠单抗二季度销售额4.8亿元,上半年销售额约8亿元,同比增长148%。上半年研发投入6.77亿美元,同比增长14.66%。BTK抑制剂泽布替尼第二季度销量2.7亿元,半年销售额超4亿元,同比增长737%。
国际药讯
1.PD-1组合疗法达到Ⅲ期临床终点。再生元(Regeneron)和赛诺菲(Sanofi)联合开发的PD-1抑制剂Libtayo(cemiplimab-rwlc),与含铂双重化疗联用,在一线治疗晚期非小细胞肺癌(NSCLC)的Ⅲ期临床EMPOWER-Lung中达到总生存期(OS)的主要终点,试验提前终止。中期分析显示,与对照组相比,Libtayo联合化疗使死亡风险降低29% (HR: 0.71; 95% CI: 0.53-0.93; p=0.014);中位OS为22个月(vs13个月);未发现新安全性信号。详细数据将于医学会议上公布。
2.创新GLP-1拮抗剂获突破性疗法认定。FDA授予Eiger BioPharmaceuticals公司“first-in-class”GLP-1拮抗剂avexitide突破性疗法认定,用于治疗先天性高胰岛素血症(HI)。在13例患有HI新生儿和婴儿中开展的II期试验结果显示,Avexitide 100、200和1,000 pmol/kg/min递增剂量相较于安慰剂分别使GIR(葡萄糖输注率)降低1.3(15%)、2.9(24%)和4.3(56%) mg/kg/min;最高剂量组50%患者完全不需要葡萄糖;而且Avexitide耐受性良好,没有严重不良事件发生。此前,Avexitide已获得FDA授予的孤儿药资格和罕见儿科疾病指定。
3.Novavax公司增强型新冠疫苗临床结果积极。Novavax公司基于Matrix-M佐剂的重组纳米颗粒蛋白新冠疫苗NVX-CoV2373,在第三针接种试验中获积极结果。两针完全接种6个月后接种单剂加强针,初步数据显示,第三剂疫苗接种后28天,与第二次接种后的峰值反应相比,抗刺突蛋白IgG抗体水平增加约4.6倍;其中针对Delta(B.1.617.2)变种的免疫应答提升了6.6倍。完整数据将提交给同行评议刊物。
4.PepGen拟加速开发寡核苷酸疗法。PepGen公司宣布完成1.125亿美元的融资。PepGen专有的增强递送寡核苷酸(EDOs)技术平台能有效地将寡核苷酸药物递送到肌肉(包括心脏组织)中,以治疗神经肌肉和神经系统疾病。此次融资将用于推进其拟用于治疗杜氏肌营养不良的“best-in-class”寡核苷酸药物EDO51在2022年进入Ⅰ期临床;以及用于治疗1型强直性肌营养不良(DM1)的EDODM1在2023年初进入临床试验。
5.再生元终止开发阿柏西普缓释剂。Ocular Therapeutix宣布,终止与再生元合作开发畅销眼科用药阿柏西普缓释剂的协议。阿柏西普是拜耳和再生元共同开发的一款抗VEGF药物,已获批用于治疗湿性年龄相关性黄斑变性、糖尿病性视网膜病变以及糖尿病和非糖尿病性黄斑水肿,去年销售额为83.6亿美元。该药可能面临2025年专利到期的挑战。
6.美国将启动对aducanumab批准程序调查。美国卫生与公共服务部将对渤健/卫材阿尔茨海默病新药(AD)Aduhelm(aducanumab)的批准程序进行审查。6月7日,FDA基于III期临床中替代指标出现阳性结果,加速批准了这款Aβ抗体上市,用于治疗早期AD患者。该部门将评估FDA相关政策和程序的应用是否存在药品官员与其他外部实体的不当关系,为利益相关者提供有意义的信息,并促进FDA的最佳项目管理。
医药热点
1.卫生技术人员评职称破除“四唯”。人力资源社会保障部、国家卫健委、国家中医药管理局印发《关于深化卫生专业技术人员职称制度改革的指导意见》。《指导意见》明确,破除唯论文、唯学历、唯奖项、唯“帽子”等倾向,不把论文、科研项目、获奖情况、出国(出境)学习经历、博士学位等作为职称申报的必要条件;科学合理对待论文,在职称评审和岗位聘任各个环节,不得把论文篇数和SCI(科学引文索引)等相关指标作为前置条件和评审的直接依据。
2.世卫:或以星座命名新冠变异毒株。世卫组织新冠疫情技术部门负责人范科霍夫日前透露,世卫组织正在为新冠变异毒株寻找新的命名方式,一旦希腊字母用完,世卫组织考虑用星座来命名新的新冠变异毒株。为了避免对相关国家造成污名化,世卫组织5月31日宣布把最早在英国、印度等国发现的新冠变异病毒的名称改用希腊字母命名。截至目前,世卫组织已用希腊字母命名了11种新冠变异毒株。
3.12家药企入选“2021年中国医药新锐创新力量”。由中国医药工业信息中心主办的《2021年(第38届)全国医药工业信息年会》发布了“2021年中国医药新锐创新力量”榜单,共12家公司入选。12家公司分别为贝达药业、再鼎医药、君实生物、德琪医药、和记黄埔医药、天境生物、斯微生物、轩竹生物、迈威生物、艾力斯医药、东方百泰生物、迪哲医药。
审评动向
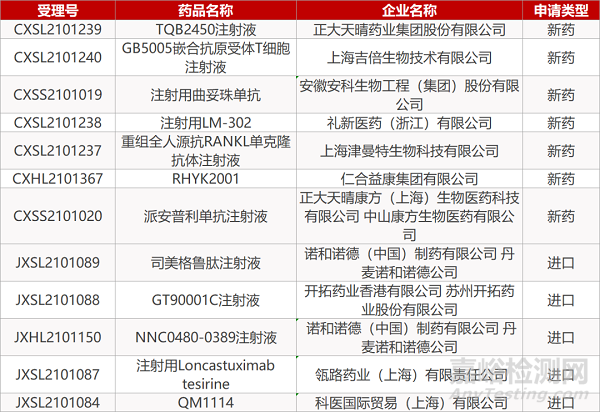
申请临床:
正大天晴的TQB2450注射液、上海吉倍生物的GB5005嵌合抗原受体T细胞注射液、礼新医药的注射用LM-302、上海津曼特生物的重组全人源抗RANKL单克隆抗体注射液、仁合益康集团的RHYK2001、诺和诺德的司美格鲁肽注射液和NNC0480-0389注射液、开拓药业的GT90001C注射液、瓴路药业的注射用Loncastuximab tesirine、科医国际的QM1114。
申请生产:
安徽安科生物的注射用曲妥珠单抗、正大天晴康方(上海)/中山康方的派安普利单抗注射液。

来源:药研发


