您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-12 18:21
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
基石普拉替尼新适应症拟纳入优先审评。基石药业RET抑制剂普拉替尼(pralsetinib)胶囊的新适应症上市申请获CDE拟纳入优先审评,拟定适应症为符合特定条件的RET突变型甲状腺髓样癌(MTC)患者和RET融合阳性甲状腺癌患者。值得一提的是,普拉替尼于今年3月刚在中国获批用于治疗RET基因融合阳性的非小细胞肺癌(NSCLC)患者,是首个在中国获批上市的RET抑制剂。
国内药讯
1.豪森第三代EGFR-TKI拟纳入突破性治疗品种。豪森药业抗肿瘤新药HS-10296片(阿美替尼)获CDE拟纳入突破性治疗品种,适应症为用于EGFR突变阳性、局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。HS-10296是中国首个获批的国产第三代EGFR-TKI类创新药,国家药监局去年3月已批准该新药用于治疗既往经EGFR-TKI治疗进展,且T790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者。
2.清普生物中美双报新药QP001国内获批临床。南京清普生物自主研发的2.2类改良型新药QP001获国家药监局临床试验默示许可。QP001是一种静脉注射用非甾体类抗炎药,拟用于术后中重度疼痛的治疗。在美国,QP001已于去年年底获得FDA Pre-IND回复,豁免临床试验,清普生物预计于2022年按照505(b)(2)途径向FDA提交新药上市申请(NDA)。
3.百济神州CD70抗体申报临床。百济神州1类新药SEA-CD70的临床试验申请获CDE受理。SEA-CD70是Seagen公司开发的一款CD70抗体,百济神州拥有在亚洲(除日本)以及部分其他地区开发SEA-CD70的权利。去年1月,Seagen公司在clinicaltrials网站登记启动一项I期临床(NCT04227847),评估SEA-CD70治疗骨髓增生异常综合征(MDS)和急性髓系白血病(AML)的疗效。截止日前,全球尚无同靶点药物获批上市。
4.朗来科技P2X3选择性拮抗剂申报临床。朗来科技自主研发的化药1类新药QR052107B片的临床试验申请获CDE受理。QR052107B是一款新一代高选择性的P2X3拮抗剂,拟用于难治性和/或不明原因慢性咳嗽的治疗。此外,非临床研究显示, QR052107B在疼痛、瘙痒等动物药效模型中表现出明确的药效作用,该公司计划将同步拓展QR052107B在疼痛、瘙痒等相关适应症的临床研究。
5.康柏西普眼用注射液停止国际Ⅲ期研究。康弘药业宣布停止康柏西普眼用注射液治疗新生血管性年龄相关性黄斑变性患者的全球多中心临床PANDA试验。中期数据显示,该新药安全性良好;在亚裔人群的亚组分析中,1mg康柏西普每三个月注射一次的剂量组疗效表现可能优于整体。但由于疫情期间大量受试者偏离试验规定的给药方案等原因,该试验科学指导委员会认为数据未达预期目标,建议停止PANDA试验。
国际药讯
1.NEJM首次揭示新冠疫苗接种后血栓形成潜在机理。《新英格兰医学杂志》日前同时发表了两项重要研究,对在接种腺病毒新冠疫苗ChAdOx1 nCoV-19之后出现血栓形成和血小板减少症状的患者进行了分析,发现所有患者的血液中出现高水平的针对血小板因子4-(PF4-)肝素复合物或PF4的抗体反应。这种抗体能够激活血小板,导致血栓的不正常形成和游离血小板数目的下降。目前尚不清楚这些抗体是如何形成的,有待进一步的研究。
2.礼来西妥昔单抗新型给药方案获FDA批准。FDA批准礼来靶向抗癌药Erbitux(cetuximab,西妥昔单抗)一种新的剂量方案:500mg/m2作为120分钟静脉输液、每2周一次(Q2W),用于治疗K-Ras野生型、EGFR表达阳性的转移性结直肠癌和头颈部鳞状细胞癌。Erbitux是全球首个靶向EGFR的单抗,由ImClone研制,已于2004年在美国获批上市,礼来于2008年出资65亿美元将其收购。
3.Opdivo组合一线治疗食管鳞癌达Ⅲ期主要终点。百时美施贵宝PD-1抑制剂Opdivo(纳武利尤单抗)与化疗或化疗+抗CTLA-4单抗Yervoy联用,作为一线疗法在治疗无法切除的晚期或转移性食管鳞状细胞癌(ESCC)的Ⅲ期临床中达到主要终点。中期结果显示,与化疗相比,Opdivo联合化疗显著延长患者的总生存期(OS);同时这一组合也显著改善了PD-L1表达患者的无进展生存期(PFS)。Opdivo与化疗和Yervoy联用,也显著延长患者的总生存期;不过在PD-L1表达的患者中,这一组合并未达到PFS的主要终点。
4.Keytruda辅助治疗肾细胞癌Ⅲ期临床结果积极。默沙东PD-1抑制剂Keytruda用于早期肾细胞癌患者辅助治疗的Ⅲ期临床达主要终点。中期分析结果显示,在接受手术治疗后的早期肾细胞癌患者中,Keytruda与安慰剂相比显著提高患者的无病生存期(DFS)。目前,这项临床试验正在进行当中,将继续评估Keytruda治疗对患者总生存期的影响。这是首次PD-1疗法作为辅助治疗,在治疗早期肾细胞癌患者时获得积极结果。
5.“first-in-class” LAG-3疗法获FDA快速通道资格。FDA授予Immutep公司可溶性LAG-3融合蛋白eftilagimod alpha(又名efti或IMP321)快速通道资格,用于一线治疗复发或转移性头颈鳞状细胞癌(HNSCC)。快速通道资格的授予是基于Ⅱ期临床TACTI-002的积极数据。在这项试验中,Eftilagimod alpha与Keytruda联用,作为二线疗法治疗HNSCC患者时,达到36%的总缓解率。这些患者此前未接受过PD-1或PD-L1抑制剂的治疗。Immutep计划启动Ⅱb期临床评估Eftilagimod alpha与Keytruda联用,一线治疗HNSCC患者的效果。
6.辉瑞联手Celcuity开发PI3K/mTOR抑制剂。细胞分析公司Celcuity宣布与辉瑞达成合作许可协议,获得辉瑞一款处于Ⅰb期拟用于治疗ER+/HER2-晚期或转移性乳腺癌患者的pan-PI3K/mTOR抑制剂gedatolisib的全球开发和商业化权益。根据协议,Celcuity将支付了500万美元的现金和500万美元的Celcuity普通股作为预付款,辉瑞将获得3.3亿美元的开发和销售里程碑式付款,以及产品的分层特许权使用费。
医药热点
1.超九成养老机构能提供医疗服务。4月8日,国家卫健委召开例行新闻发布会,介绍我国医养结合工作进展成效有关情况。截至去年年底,全国共有两证齐全的医养结合机构5857家,比2017年年底增加59.4%,医疗卫生机构与养老服务机构建立签约合作关系的有7.2万对,是2017年年底的6.1倍。两证齐全的医养结合机构床位数达到158.5万张,超过90%的养老机构能以不同形式为入住的老年人提供医疗卫生服务。
2.更多门诊费用将纳入医保报销。4月7日召开的国务院常务会议,确定建立健全职工基本医保门诊共济保障机制的措施,拓宽个人账户资金使用范围,减轻群众医疗负担。会议同时明确指出,下一步要深化医改,增强职工基本医保互助共济保障功能,将更多门诊费用纳入医保报销,进一步减轻患者负担。
3.《中国常见消化系统疾病科普白皮书》发布。4月9日是国际护胃日,由中国医师协会医学科学普及分会消化学组编撰审核的《中国常见消化系统疾病科普白皮书》在北京正式发布。《白皮书》介绍了常见消化系统疾病症状及其相关的生活指导、药物选择、经验性治疗方法等,让公众学会通过识别典型的症状去判断常见的消化系统疾病,居家开展合理经验性治疗,最终达到提高疾病认知和重视的效果,以及早发现,早诊断、早治疗的目的。
4.英国研究显示阳光充足程度关联新冠病亡人数。爱丁堡大学研究团队日前在《英国皮肤病学杂志》上登载一篇最新研究成果。就紫外线水平和新冠病亡人数,研究小组比较了去年1月至4月间新冠疫情“重灾区”美国、英国、意大利的相关数据,分析发现新冠死亡率、季节和纬度之间存在关联,一些地方新冠病亡人数少与当地阳光比较充足有关。研究人员同时强调该项研究中新冠病亡率减少与“维生素D” 无关。
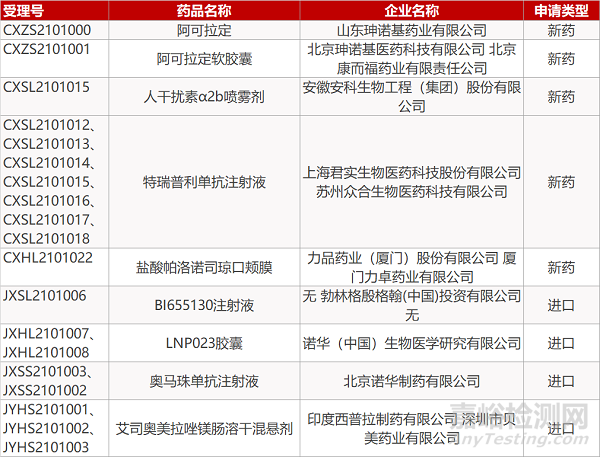
审评动向
安徽安科的人干扰素α2b喷雾剂、上海君实/苏州众合的特瑞普利单抗注射液(7个规格)、力品药业/厦门力卓的盐酸帕洛诺司琼口颊膜、勃林格殷格翰的BI655130注射液、诺华的LNP023胶囊(2个规格)。
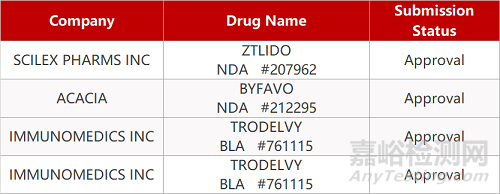
2. FDA新药获批情况(北美04月08日)

来源:药研发


