您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-07 15:21
「 本文共:17条资讯,阅读时长约:3分钟 」
今日头条
杨森/传奇生物CAR-T疗法在美完成滚动申报上市。传奇生物与杨森公司完成了向FDA滚动提交BCMA靶向CAR-T疗法ciltacabtagene autoleucel(cilta-cel)的生物制品许可申请,用于治疗复发/难治性多发性骨髓瘤成人患者。一项在ASH2020年会上公布的Ⅰb/Ⅱ期临床CARTITUDE-1数据显示,在中位随访为12.4个月时,cilta-cel在这类患者中的ORR达到97%,CR达到67%。该疗法此前已获FDA授予突破性疗法认定,预计今年年底前将获得FDA的批准。
国内药讯
1.科望新一代OX-40激动剂ES102启动中国临床。科望医药1类新药ES102在治疗经标准治疗失败的晚期恶性实体瘤患者的Ⅰ期临床中完成首例患者给药。ES102是一款 “first-in-class” OX40靶向的六价抗体,正在美国进行单药以及与帕博利珠单抗联合用药的临床研究。临床数据表明,ES102耐受性良好,并显示出初步抗肿瘤活性。目前,科望医药在中国也已完成向NMPA递交ES102联合特瑞普利单抗治疗实体瘤的临床试验申请。
2.德琪双靶点抑制剂ATG-019获批国内临床。德琪医药PAK4/NAMPT双靶点抑制剂ATG-019获国家药监局临床试验默示许可,即将开展ATG-019单药或联合维生素B3/菸碱酸治疗中国晚期实体肿瘤或非霍奇金淋巴瘤的I期临床。ATG-019是Karyopharm公司开发的一款新型口服小分子药物,德琪拥有该新药在大中华区、韩国、澳大利亚、新西兰和东盟国家的独家开发和商业化权益。此次是ATG-019在中国大陆的首个临床试验。
3.信立泰SAL0104胶囊获批四项临床。信立泰创新药SAL0104胶囊获国家药监局四项临床试验默示许可。SAL0104是一款凝血因子XIa抑制剂,在降低血栓发病率的同时,兼具出血风险小的特点。该新药获批的四项临床适应症分别为:①终末期肾透析患者心血管事件(心血管死亡、心肌梗死、卒中和静脉血栓栓塞症)预防;②缺血性卒中和短暂性脑缺血二级预防;③全膝关节置换术后静脉血栓预防;④非瓣膜性心房颤动患者卒中和体循环栓塞预防。
4.贝达CDK4/6抑制剂BPI-16350联合用药申报临床。贝达药业自主研发并拥有完全自主知识产权的创新药BPI-16350联合氟维司群或芳香化酶抑制剂治疗乳腺癌的临床试验申请获CDE受理。BPI-16350是一款CDK4/6抑制剂,已于2018年获批开展单药用于晚期实体瘤的临床试验,目前这项I期临床正在进行中。截至日前,全球共有四款CDK4/6抑制剂获批,其中辉瑞的Palbociclib和礼来的Abemaciclib已在中国获批上市。
5.沪亚生物与BMS开展联合用药研究。沪亚生物表观遗传调控剂西达本胺(HBI-8000)拟与百时美施贵宝PD-1欧狄沃开展III期临床,评估这一组合治疗PD-1药物初治的不可手术切除、转移性黑色素瘤的疗效。西达本胺是沪亚生物合作伙伴微芯生物自主研发的一款新型亚型选择性HDAC抑制剂,目前在中国已获批治疗外周T细胞淋巴瘤(PTCL),与联合内分泌药物治疗的复发/转移性ER阳性、HER2阴性晚期乳腺癌患者。
国际药讯
1.FDA批准十年来首款非兴奋剂多动症疗法。Supernus公司去甲肾上腺素再摄取抑制剂Qelbree(viloxazine缓释胶囊)获FDA批准上市,用于治疗6-17岁的注意力缺陷多动障碍(ADHD)患者。这也是十年来首款治疗ADHD的创新非兴奋剂疗法。去年12月,这款创新疗法在治疗成人ADHD患者的Ⅲ期临床中也获得了积极的结果,该公司计划今年下半年递交补充新药申请,扩展Qelbree在成人患者中使用。
2.诺华奥法妥木单抗获欧盟批准上市。诺华每月一次皮下注射给药的CD20单抗Kesimpta(奥法妥木单抗)获欧盟委员会(EC)批准上市,用于治疗由临床或影像学特征定义的复发性多发性硬化(RMS)成人患者。本次批准是基于Ⅲ期临床ASCLEPIOS的第一和第二阶段试验的数据。在美国,FDA已于去年8月批准Kesimpta用于治疗RMS,包括成人临床孤立综合征(CIS)、复发缓解型MS和活动性继发进展型MS。
3.独特早筛检测获FDA突破性医疗器械认定。FDA授予Bluestar Genomics无创胰腺癌早筛检测突破性医疗器械认定,用于在新发作的糖尿病患者中筛查胰腺癌。这一检测旨在利用普通血检时抽取的血液样本,通过检测循环无细胞DNA上名为羟甲基胞嘧啶(5hmC)的生物标志物的变化,发现早期胰腺癌。胰腺癌为“癌症之王”,它难以治疗的原因之一是早期胰腺癌的症状轻微,大多数患者在确诊时已处于晚期。目前胰腺癌没有推荐的早筛检测。
4.Samjin寡核苷酸偶联药物获FDA孤儿药资格。Samjin Pharmaceutical适体-核苷偶联药物SJP1604获FDA授予孤儿药资格,拟用于治疗急性髓系白血病(AML)。SJP1604可通过靶向在癌细胞的细胞膜上高度表达的核仁素(nucleolin),将药物递送至癌细胞中。由于其独特的构象特性,它具有高度靶向能力和血浆中的稳定性。在小鼠模型中已显示出良好的抗白血病活性,在体外实验中与venetoclax联用表现出协同效应。
5.Acadia重磅痴呆症药物Nuplazid遭FDA拒绝。FDA针对Acadia公司帕金森药物Nuplazid(pimavanserin)治疗痴呆症相关精神病患者的补充新药申请(sNDA)发出一份完整回复函(CRL)。FDA认为Nuplazid在一些痴呆亚组中缺乏统计学意义,没有足够多的痴呆亚型患者表现出有效性,未提出安全问题。Nuplazid是一款血清素受体反向激动剂,是首款也是唯一一款获批用于与帕金森病相关的幻觉和妄想的药物。
6.强生联手Cidara开发新型抗流感药物。强生子公司杨森与Cidara公司就Cidara的新型抗病毒缀合物CD388达成研发许可协议。CD388是一款长效抗病毒药物,拟用于单剂治疗和预防所有流感毒株。根据协议,Cidara将获2,700万美元前期付款、7.53亿美元的研发预算和里程碑付款,以及产品的销售分成;杨森将负责候选产品的后期开发、生产和商业化。此项协议还包括Cidara的另一个款候选项目CD377。
医药热点
1.印度单日新增新冠确诊病例超10万例。印度卫生部5日发布的疫情数据显示,印度过去24小时新增新冠确诊病例103558例,创单日新增确诊病例数新高,新增死亡478例。截至5日,印度累计确诊12589067例,累计死亡165101例。卫生专家指出,当前疫情反弹的原因可能是戴口罩和保持社交距离等防疫措施执行不严格和病毒变异等造成。印度已于1月16日启动新冠疫苗接种,目前接种疫苗人数已达7900多万。
2.广东鼓励基层医院向康复护理转型。广东省日前印发《广东省关于加快发展老年护理服务的工作方案》,提出到2022年,全省老年护理服务相关制度、标准和规范基本建立,老年护理服务体系逐步完善,基层医疗卫生机构护理床位占比达到30%,二级及以上综合医院设立老年医学科的比例达到50%。该省同时还鼓励医疗资源丰富地区的部分一级、二级医院转型为护理院、康复医院等。
3.成都探索住院患者“无陪模式”。四川省成都市第三人民医院日前启动了“医院陪护服务管理”项目。据悉,该项目由医院护理部牵头组建,针对全院220余名陪护人员制订了培训与管理方案。患者可选择适合自身的陪护项目或选择“无陪模式”,解决住院期间的照护问题。“无陪模式”是指患者住院期间的陪护,全部交由专业陪护人员承担。
4.河南抬高医学教育准入门槛。河南省发布《河南省加快医学教育创新发展实施方案》提出,发展本科医学专业教育,扩大研究生招生规模,支持医学院校申请创建博士学位授权单位;提高医学教育准入门槛,无相关医学类专业基础的非医学院校不得设置医药卫生类专业,已设置本科医药卫生类专业的高校,对应专科专业不再招生;高校不再举办医卫类专业中等职业教育,医卫类中等职业教育逐步转向为乡村基层和养老托育等培养人才等。
5.亚盛任命知名肿瘤学专家David Sidransky为独立非执行董事。亚盛医药日前宣布任命知名肿瘤学专家David Sidransky博士为独立非执行董事,该任命自2021年3月31日起生效。Sidransky博士2001年被《时代》杂志评为美国最优秀的医生及科学家之一,以应用生物标志物进行早期诊断与治疗的研究闻名。Sidransky博士现担任约翰·霍普金斯大学头颈癌研究部主任、耳鼻喉科-头颈外科教授、细胞和分子医学教授、泌尿外科和遗传学教授及约翰霍普金斯大学肿瘤学中心的肿瘤学教授。
审评动向
暂无
2. FDA新药获批情况(北美04月02日)
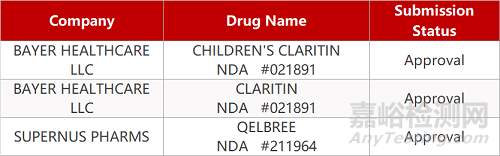

来源:药研发


