您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-12-10 17:24
1.前言
病毒,一类严格的细胞内寄生物。在宿主细胞外环境,病毒既不能独立进行代谢活动,也不能进行繁殖,只能以颗粒形态存在,即病毒体(virion)的形态存在。病毒死亡,由蛋白质外壳的分裂和核酸退化导致的病毒浓度随时间的降低。死亡的病毒不会感染宿主细胞, 因而丧失对人畜健康危害(没有生物活性,不能主动进入细胞,也不能在细胞内进行复制)[1]。清除病毒的方法有很多,按病毒去除/灭活方式的不同,可分为有机溶剂/去污剂(S/D)法、低pH值孵放法、膜过滤法、紫外法、超短时微波加热法、巴氏消毒法和干热法等[24]。下面将介绍一些常见病毒去除/灭活方法。
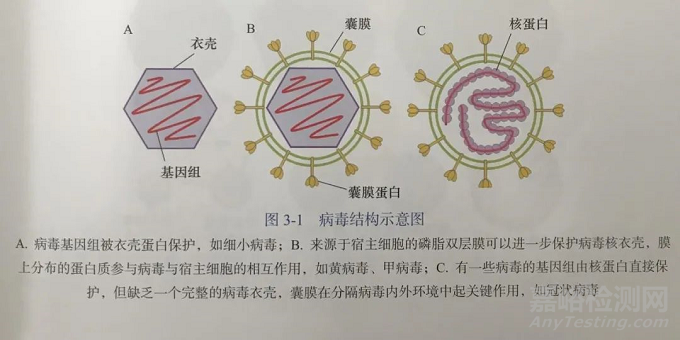
图为病毒结构
(出自胡志红、陈新文主编的《普通病毒学》)
2.病毒去除/灭活技术介绍
2.1有机溶剂/去污剂病毒(S/D)灭活法
过去,人们发现甲肝病毒能通过消化道传播,乙肝病毒通常不能通过消化道传播,但是在胆汁分泌障碍人群体内,乙肝病毒能通过消化道传播的概率较高。后来,科学研究发现,这与胆汁能溶解乙肝病毒的脂包膜有关。根据以上原理,通过研究和临床观察发现,使用Triton-X 45这类的非离子型表面活性剂(去污剂)和磷酸三丁酯(有机溶剂)能够有效破坏类似乙肝病毒的类脂膜:类脂从病毒表面脱落,使病毒失去黏附和感染细胞的能力,从而达到灭活病毒的效果,且对蛋白质分子的结构的影响也非常小[4]。这种方法就是有机溶剂/去污剂病毒(S/D)灭活法。
因S/D法具有较高病毒去除作用、蛋白相容性高、易于插入到现有或新开发的纯化工艺中等优点[16],人们便将这种灭毒方法用于血浆、血液制品和生物制品[8,17,18,19]。S/D法作为血浆病原体灭活技术,是最早得到医疗界的认可,并投入临床中的。因为S/D法满足了以下三点:①能完全有效灭活胞内、胞外病原体及附着在细胞上的病原体;②所选试剂能选择性地进入细胞且不损伤细胞;③经处理后的红细胞不产生新抗原或者抗体,对人体无害。因为S/D病毒灭活处理对多种不同的包膜病毒都能发挥有效的病毒灭活作用,且有良好的临床安全性,因此其通过美国FDA许可,以用于浓缩的人血液Ⅷ因子的病毒灭活,并已广泛用于生物制品的生产[9,10,11,12]。
在使用S/D法时需要注意:①待灭活的制品中,可能存在颗粒性物质会将病毒包裹其中,这会使S/D试剂无法接触到病毒。因此,需要对制品事先进行1μm或更高的精度的过滤以避免这种风险。②加入S/D后制品应充分混匀,如果加入S/D后再进行过滤,应确保过滤后S/D浓度仍在有效范围内。③S/D试剂要能够与混合容器内每一滴制品接触(特别是罐壁、灌顶上附着的制品可能在灭活工艺结束后又滴入罐内),因此通常是将加入S/D后的制品混合均匀后,泵入另外的容器内恒温,执行灭活程序。④病毒灭活间与后面的生产工序间需要分开,以免造成交叉污染。
S/D法缺点也比较明显:这种灭活方法仅对脂包膜病毒有效,对于非脂包膜病毒无任何效果。而且,虽然S/D法现在被广泛应用于临床,但也存在基因毒性、处理物及其衍生物残留﹑灭活后部分凝血因子减低等问题。
2.2低pH孵放技术
低pH孵放法,是一种化学病毒去除/灭活技术,常用于单克隆抗体的病毒灭活工艺。其原理是利用病毒表面抗原在低pH值的条件下,电荷会发生改变,蛋白质的空间结构也会发生不可逆的改变,从而使病毒丧失侵染细胞的能力。简单来说,低pH孵放法是破坏病毒包膜的完整性、阻断病毒与宿主受体结合的途径,使病毒无法感染宿主细胞,起到灭活病毒的作用[20,21,22,23]。
低pH孵放法虽然因其操作过程简单、病毒灭活效果好,成为重组蛋白药物纯化工艺中常用的关键步骤,但低pH环境容易使重组蛋白不稳定,产生聚体、降解等质量问题。相比较而言,由于抗体类免疫球蛋白在低pH环境普遍表现更加稳定,因此低pH孵放法主要应用在IgG类产品。另外,低pH孵放法具有方法简单、经济实惠、容易操作等特点,已被用于伪狂犬病毒、猪细小病毒、流感病毒等病毒的灭活[5,6]。
在工艺操作过程中需要注意:本方法对于无脂包膜类病毒作用微弱(仅部分非脂包膜病毒有效),但在工艺中的低pH(如pH 4)处理(有时加胃酶)能灭活几种脂包膜病毒。除此之外,病毒灭活效果可能受pH值、孵放时间和温度、胃酶含量、蛋白质浓度、溶质含量等因素影响。随着pH升高,灭活效果降低,随着温度升高,灭活效果升高,通常可以达到5~6LRV灭活效果。在pH 3.7、pH 3.8时,其灭活效果会受多因素干扰。而样品中含有一定量的精氨酸时可以改善病毒灭活效果,即使在pH 4.0的条件下也有显著的灭活效果。低pH孵放不仅可以灭活有脂包膜类病毒,还可以沉淀HCP、DNA等杂质,对纯化工艺中的杂质去除也起到重要作用[5,6]。
2.3纳米膜过滤技术
纳米膜过滤技术是一种通过孔径大小过滤来滤除病毒的技术,多用于血液制品和生物制品中的病毒去除,其可以有效去除非脂包膜病毒。作为生物制品净化过程中最常用的技术之一,其目的是达到有效的净化效果,保证生物制品的安全[25]。得益于生物治疗产品如单克隆抗体、干细胞产品、血液成分、生物制剂和疫苗不断增长的需求,未来几年全球病毒过滤市场预计呈现增长的趋势。
纳米膜过滤是利用病毒和蛋白大小的不同,小于平均孔径的蛋白通过滤膜,大于平均孔径的病毒截留在膜内,从而达到去除病毒的效果[7]。纳米膜过滤可以同时满足病毒去除效果好、目的蛋白质通过性高(回收量、过滤时间)、目的蛋白质不变性的特点,另外不管是脂包膜病毒还是非脂包膜病毒,无论病毒基因组是RNA还是DNA,基本靠孔径大小来去除病毒,所以是当前最可靠的病毒去除、灭活技术。根据目的蛋白的大小,可以选择平均孔径不同的滤膜。在滤过产品中,平均孔径为20 nm左右的产品被称为细小病毒滤膜。近年来,由于去除小病毒的需求的提高,这种产品得到了广泛的应用。其中平均孔径35~50 nm的滤膜被称为逆转录酶病毒滤膜[2,3]。
在实际的生产过程中,为了提高蛋白回收率,需要暂停压力,然后将流路切换到清洗缓冲槽进行后冲洗。病毒过滤的最劣条件之一是高TMP(跨膜压差)。近年来的报告表明,过滤过程中压力的释放及之后的再加压都会影响病毒去除效果。特别是在添加细小病毒和噬菌体进行的实验中,在压力暂停后再次加压,会从滤液中检测出病毒粒子。这种现象不是某种病毒滤膜所特有的,而是所有病毒滤膜产品的普遍现象。发生这种现象的原因在于,暂停压力后,被截留在膜内的病毒粒子会再进行布朗运动,离开膜壁,再次加压后,附近若有粒径较大的滤孔,病毒粒子又会通过而漏出膜外。当然,这不意味着病毒粒子一定会漏出。病毒漏出与否、漏出量取决于过滤对象溶液的性质、过滤压力、压力暂停时间、病毒种类、病毒滴度/量和病毒滤膜的种类[2][3]。
为了判断生产工艺的影响,需要使用模拟实际工艺的缩小模型进行病毒去除试验。如果生产工艺中有压力释放过程的话,做病毒验证实验方案时要考虑这一因素。实际生产过程中的流路一般会有阀门,在模拟时可以使用旋塞来代替阀门,尽可能使用试验流路接近实际的生产环境。如果观察到病毒漏出,可以通过改变过滤条件来降低或消除风险。压力释放的影响取决于具体情况,应设想在预想不到的压力释放的情况下,是继续过滤,还是更换滤膜,针对不同的蛋白提前采取对应措施是有意义的。
2.4紫外灯照射法
紫外灯杀毒法的主要仪器是紫外线杀菌灯。紫外线杀菌灯通常也被称为紫外线消毒灯或紫外线荧光灯,是一种利用紫外线的杀菌作用进行灭菌消毒的灯具。紫外线杀菌灯消毒原理主要是在特定的波长范围(灯波长为200~275nm,杀菌作用最强的波段是250~270nm)以及足够高的剂量下,通过辐射损伤和破坏微生物的核酸功能来杀灭微生物等病原体[26]。具体来说,是紫外线对核酸的作用引起细菌和病毒等微生物细胞中DNA或RNA相邻嘧啶分子间形成异常的化学键,从而阻碍DNA或RNA的复制,而且在紫外线灯杀菌的过程中还会产生臭氧,臭氧本身就能从外而内的逐步破坏病毒结构,从而造成微生物细胞死亡,以达到消毒的目的[13,14,15]。
常见的紫外线杀菌消毒属于照射消毒,只需将紫外线杀菌灯照射需要消毒的物品,或在需要杀菌消毒的环境放置紫外线杀菌灯(使用时可将紫外线消毒灯悬吊于处方上方1m或将处方置于紫外线消毒箱内)即可。紫外线可集中很高的强度在短时间内杀灭细菌和病毒,属于纯物理消毒方法[13]。
紫外线消毒具有性能稳定、使用维护便捷、运行成本低、对环境友好等优点,但是紫外线穿透能力弱,仅对直接照射的物体表面有消毒作用,所以消毒处方时应保证每张处方的正反两面均受到照射。另外,紫外线可对皮肤黏膜造成损害,因 此使用时应避免直接照射到人[14,15]。
紫外线灯在使用过程中会产生臭氧。臭氧的浓度过高会使人产生头晕、恶心等症状,甚至会引发呼吸道的病变。而长期错误使用紫外线灯会对人眼睛产生危害:诱发结膜、角膜等疾病,严重的甚至会影响视力。不仅如此,如果长期照射到皮肤上,轻者会出现红肿、瘙痒等症,重者甚至会引发皮肤癌[14,15]。
图为一种正在运行的迷你紫外灯消毒箱
3.小结
当前广泛使用的病毒灭活方法有S/D法、低pH孵放法、膜过滤法、紫外法等,本文也对这些方法进行了一些介绍。虽然每种病毒灭活方法都可以灭活常见的病毒,但每种方法都有其局限性。国内IND申报时,一般选择低pH和膜过滤这两个工艺。国外进行申报时,除了选择低pH和膜过滤这两个工艺,还需进行层析工艺(层析法最常用的是亲和层析和离子交换层析。层析法是目前常用的样品不同组分分离技术,利用各组分与固定相亲和力的差异或相互作用不同的原理,实现病毒与样品分离的目的)。
去除/灭活病毒的理想方法有2个特性:①可以部分去除病毒或者破坏病毒的活性和结构。②维持生物制品的生物活性、理化性质。
当掌握对某种病毒的精准去除/灭活或能够对产品中所有的病毒进行去除/灭活,并保证产品功能性质完整时,消毒后的产品才能具有效益和继续增加效益。
参考文献
【1】周德庆著.微生物学教程.北京:高等教育出版社, 1993. Zhou D Q .Microbiology Tutorial (In Chinese) .Beijing :Higher Education Press, 1993
【2】Jin Y, Flury M.Fate and transport of viruses in porous media .Advances in Agronomy, 2002, 77:39~ 102
【3】Gerba C P,Keswick B H,Dupont H L,et al .Isolation of rotavirus from drinking water .Monogr .Virol.,1984,15:119~125
【4】Burnouf T, Chou ML, Cheng LH, et al. Dengue virus inactivation by minipool TnBP/Triton X-45 treatment of plasma and cryoprecipitate. Vox Sang, 2013, 104(1):1-6.
【5】Chinniah S, Hinckley P, Connell-Crowley L. Characterization of operating parameters for XMuLV inactivation by low pH treatment. Biotechnol Prog, 2016, 32(1):89-97.
【6】Yamasaki H, Tsujimoto K, Koyama AH, et al. Arginine facilitates inactivation of enveloped viruses. J Pharm Sci, 2008, 97(8):3067- 3073.
【7】Hamamoto Y, Harada S, Kobayashi S, et al. A novel method for removal of human immunodeficiency virus: filtration with porous polymeric membranes. Vox Sang, 1989, 56(4):230-236.
【8】Cicchetti A, Berrino A, Casini M, et al. Health Technology Assessment of pathogen reduction technologies applied to plasma for clinical use. Blood Transfus, 2016, 14(4):287-386.
【9】Zubkova N.V.,Anastasiev V.V.,Kyuregyan K.K.,et al.Estimation of efficiency of solvent-detergent method for virus inactivation in the technology of immunoglobulin production on the model of duck hepatitis B virus[J].Bulletin of Experimental Biology & Medicine,2013,155(6).
【10】Heger A.,Janisch S.,Pock K.,et al.Comparative biochemical studies of fresh frozen plasma and pooled solvent/detergent-treated plasma (octaplas LG?) with focus on protein S and its impact in different thrombin generation assay set-ups.[J].Vox Sanguinis,2016,(3).266-273.
【11】Liumbruno Giancarlo Maria,Franchini Massimo.Solvent/detergent plasma: pharmaceutical characteristics and clinical experience[J].Journal of Thrombosis & Thrombolysis,2015,39(1).
【12】Roberts P.L.,Dunkerley C.,Walker C..Virus reduction in an intravenous immunoglobulin by solvent/detergent treatment, ion-exchange chromatography and terminal low pH incubation[J].Biologicals: Journal of the International Association of Biological Standardization,2012,40(5).
【13】Squillace D.M.,Zhao Z.,Call G.M.,et al.Viral Inactivation of Human Osteochondral Grafts with Methylene Blue and Light[J].Cartilage,2014,5(1).
【14】Thomas Thiele,Gregor Hron,Sarah Kellner,et al.Thrombin generation, ProC(?)Global, prothrombin time and activated partial thromboplastin time in thawed plasma stored for seven days and after methylene blue/light pathogen inactivation.[J].Blood transfusion = Trasfusione del sangue,2016.66-72.
【15】Huang CC,Wong TW,Huang HJ,et al.Methylene blue-mediated photodynamic inactivation as a novel disinfectant of enterovirus 71.[J].The Journal of Antimicrobial Chemotherapy,2010,65(10).
【16】Horowitz B.,Prince A. M.,Hamman J.,et al.Viral safety of solvent\/detergent-treated blood products[J].Blood Coagulation & Fibrinolysis,1994.S21-S28.
【17】B. Horowitz,M. E. Wiebe,A. Lippin,et al.Inactivation of viruses in labile blood derivatives. I. Disruption of lipid-enveloped viruses by tri(n-butyl)phosphate detergent combinations[J].Transfusion,1985,25(6).516~522.
【18】沈积慧,徐俊,龚鹏.凝血因子产品SD灭活病毒效果的验证[J].中国输血杂志,1996,(4).18-19.
【19】L Gürtler.[Possibilities of virus inactivation of pooled fresh plasma with tri-n-butylphosphate (TNBP) detergents (SD procedure)].[J].Infusionstherapie und Transfusionsmedizin,1994.21 Suppl 177-9.
【20】Johnston A,Uren E,Johnston D,etal.Low pH,capry late incubation as a second viral inactivation step in the manufacture of albumin parametric and validation studies[J].Biologicals,2003,31(3):213-221.
【21】Buchacher A,Lberer G,Purification of intravenous immunoglobulin G from human plasma -aspects of yield and virus safety[J].Biotechnology Joumal,2006,1(2):148-163.
【22】Lebing W.Remington K M,Schreiner C,et al.Properties of a new intravenous immuneoglobulin (IGIV-C,10%)produced by virus inactivation with caprylate and column chromamatography [J].Vox Sanguuinis,2003,84(3):193-201.
【23】Jeong E K,Sung H M,Kim I S.Inactivation and removal of influenza A virus H1N1 during the manufature of plasma derivatives[J].Biological,2010,38(6):652-657.
【24】王军志.生物技术药物研究开发和质量控制[M].2版.北京:科学出版社,2007:237-258.
【25】郑丰平,王炳,郑琪,等.DV50纳米过滤去除静注人免疫球蛋白中的病毒时流速的影响因素[J].中国生物制品学杂志,
2012,25(12):1712-1713,1718.
【26】中华人民共和国卫生部.《医疗机构消毒技术规范》(WST367-2012)[EB/OL].(2012-04-05) [2020-02-28].


来源:无菌动物


