您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-31 10:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.中国生物制药盐酸伊达比星首家通过一致性评价。中国生物制药注射用盐酸伊达比星(安必健)获国家药监局批准上市,用于治疗急性髓系白血病(AML),并视同通过一致性评价。伊达比星是一款抗肿瘤抗生素,具有药物脂溶性和抗肿瘤活性较高的特点,是国内外指南一致推荐的 AML基石治疗药物。安必健是国内同品种首个通过一致性评价的产品。
2.歌礼1类丙肝新药拉维达韦即将获批。7月29日, 歌礼制药新一代NS5A抑制剂拉维达韦上市申请进入行政审批阶段,有望近期获批,用于治疗慢性丙肝。拉维达韦是歌礼开发的第2款丙肝创新药。在一项涉及424例非肝硬化的GT1 HCV感染初治成人患者的II/III期临床中,应用拉维达韦联合利托那韦强化的达诺瑞韦和利巴韦林治疗12周后,治愈率(SVR12)高达99%,且疗效不受基线NS5A耐药相关替换影响,同时具有良好的耐受性。
3.基石药业阿泊替尼获优先审评。7月28日,CDE按照优先审评范围“(五)符合附条件批准的药品”将基石药业合作品种阿泊替尼片上市申请正式纳入优先审评审批程序。阿泊替尼是由Blueprint公司开发的一款KIT/PDGFRA抑制剂,于2020年1月获FDA批准用于治疗携带PDGFRA 外显子18突变(包括PDGFRA D842V)的晚期胃肠间质瘤成人患者,是全球首款治疗这类患者的精准靶向药物。基石药业拥有阿泊替尼在大中华区的独家开发和商业化授权。
4.嘉和生物PD-1单抗拟纳入优先审评。嘉和生物的PD-1单抗杰诺单抗(geptanolimab, GB226)注射液上市申请获CDE纳入拟优先审评公示名单,理由是“符合附条件批准”。杰诺单抗申请上市的适应症为治疗外周T细胞淋巴瘤(PTCL),这是首个在中国境内申请这一适应症的PD-1单抗。目前,杰诺单抗正在中国开展多项临床试验,涉及外周T细胞淋巴瘤、原发纵隔大B细胞淋巴瘤、宫颈癌、非小细胞肺癌等多种适应症。
5.再生之城1类创新CAR-T疗法临床申请获受理。再生之城抗HIV-1嵌合抗原受体T细胞(CAR-T)注射液临床申请获CDE受理。据悉,该疗法由中山大学张辉教授团队开发,能有效诱导感染HIV-1的CD4 T淋巴细胞的细胞溶解的嵌合抗原受体T细胞(VC-CAR-T),旨在重建可靠的免疫监测,根除重新激活的HIV-1感染细胞,具有功能性治愈艾滋病的潜能。该疗法的临床前相关研究结果已于2016年在Journal of Virology期刊上发表。
6.万泰生物和赛诺菲达成轮状病毒疫苗合作。7月30日,万泰沧海与赛诺菲就万泰沧海的新型轮状病毒疫苗在全球开发、生产及商业化达成独家许可协议。该疫苗是厦门大学与万泰沧海联合开发的一款重组蛋白疫苗,主要用于预防A型轮状病毒引起的儿童腹泻。根据协议,万泰沧海公司将获1000万美元预付款,5800万美元的里程碑付款以及商业化后疫苗净销售额1%或2%的许可费。同时万泰沧海有权从赛诺菲获得上述授权的再许可,以便在中国开发轮状病毒疫苗。
国际药讯
1.BMS重新递交CAR-T细胞疗法上市申请。百时美施贵宝(BMS)和bluebird bio公司联合宣布,已向FDA提交双方联合开发的CAR-T疗法idecabtagene vicleucel(ide-cel,bb2121)的上市申请(BLA)。这是一款靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)T细胞免疫疗法,用于治疗复发/难治性多发性骨髓瘤成人患者。本次提交提供了化学、生产和控制(CMC)模块的更多详细信息,以解决2020年3月初始BLA提交后FDA在2020年5月提出的未满足的监管要求。
2.艾伯维CGRP受体拮抗剂达到Ⅲ期终点。艾伯维在研口服CGRP受体拮抗剂atogepant在预防偏头痛的Ⅲ期临床ADVANCE中达主要终点。atogepant所有剂量组(10mg/30mg/60mg)患者偏头痛平均天数降低3.69/3.86/4.2天,显著优于安慰剂组的2.48天(p<0.0001);每月平均偏头痛发作日降低50%的患者比例分别为55.6%/58.7%/60.8%,而安慰剂组这一数值为29.0%(p<0.0001)。详细数据将在医学大会/期刊上发布。艾伯维计划近期向FDA或其他国家提交其监管申请。
3.默沙东HIF-2α抑制剂获FDA突破性疗法认定。FDA授予默沙东缺氧诱导因子-2α(HIF-2α)抑制剂MK-6482突破性疗法认定,用于治疗von Hippel-Lindau(VHL)疾病相关的肾细胞癌(RCC)患者,这些患者携带小于3厘米大小的非转移性RCC肿瘤。FDA还授予MK-6482治疗VHL疾病的孤儿药资格。在2020年美国临床肿瘤学会年会上公布的一项Ⅱ期临床结果表明,MK-6482在VHL相关透明细胞RCC患者中达到27.9%的总缓解率,86.9%的患者靶标病变缩小。
4.Moderna新冠疫苗动物实验数据发表。Moderna公司mRNA新冠疫苗mRNA-1273的动物实验结果发表于《新英格兰医学杂志》上。三组、每组8只恒河猴分别两次注射10 μg或100 μg的mRNA-1273或安慰剂。结果显示,疫苗组恒河猴血液中产生的中和抗体均高于COVID-19康复者的抗体水平,疫苗同时激活了T细胞免疫反应。在暴露于病毒两天后的恒河猴中,疫苗组各有7只恒河猴的肺部未检测到病毒复制,而安慰剂组8只恒河猴肺部均有病毒复制;此外,100 μg疫苗组的8只恒河猴鼻子中均没有检测到病毒。mRNA-1273显示出快速控制恒河猴上、下呼吸道中新冠病毒的潜力。
5.优时比与罗氏达成阿尔茨海默病新药合作。优时比公司与罗氏及其旗下基因泰克公司达成一项独家许可协议,用于其阿尔茨海默病(AD)在研重组Tau蛋白靶向单抗UCB0107在全球的开发与商业化。根据协议,优时比将获得1.2亿美元的前期付款,总额可能高达20亿美元的开发、销售里程碑付款和特许权使用费等;优时比将负责在AD中进行概念性验证研究,一旦获得该研究结果后,基因泰克有权选择继续开发或将全部权利归还给优时比。该交易仍需获得反托拉斯批准。
医药热点
1.第三批国家药品集采启动。上海阳光医药采购网发布《全国药品集中采购文件》,第三批集采涉及56个品种,将于8月20日在上海拉开帷幕。根据文件,符合资格的申报企业大于等于11家时,最多允许8家中选。而在相对应的采购周期方面,实际中选企业数为1家或2家的,采购周期原则上为1年;中选企业数为3家的,采购周期原则上为2年;中选企业数为4家及以上的,采购周期原则上为3年。其中,阿扎胞苷注射剂、莫西沙星氯化钠注射剂、左乙拉西坦注射用浓溶液本轮采购周期原则上为1年。
2.世卫组织认为群体免疫将导致更多人死亡。据美国CNBC报道,当地时间7月29日,世卫组织官员Mike Ryan称不要试图通过让新冠病毒在社区内迅速传播来实现所谓的群体免疫,这会让医院不堪重负,导致更多人死亡。大多数科学家认为60%至80%的人口需要接种疫苗或拥有天然抗体才能实现群体免疫。但Mike Ryan认为目前离这个数字还差得很远,呼吁大家做好防护措施,保护自己,保护他人。
3.休舱的武汉客厅方舱医院彻底“关张大吉”。7月29日,武汉客厅方舱医院开始拆除,并逐步恢复原有业态,预计工作需要两三天完成。该方舱医院是武汉首批方舱医院之一,仅用三天建成。3月8日休舱后,武汉客厅又先后8次对方舱内外进行全面消杀,同时维护及保洁设施设备。接下来,武汉客厅会展中心将恢复其原有场馆功能,全面承接各类展会、文艺演出等活动,助力武汉会展行业全面复工复产,推动民生与经济的全面复苏。
股市资讯
【康缘药业】公司收到国家药监局核发的泽泻降脂胶囊《药物临床试验批准通知书》。
【健友股份】(1)2020年半年度实现营业收入13.96亿元(+18.64%),实现归母净利润4.08亿元(+41.24%),实现扣非归母净利润4.04亿元(+44.30%)。(2)股东TANG YONGQUN通过上交所累计减持健友转债50.31万张,占发行总量的10%。
【卫光生物】公司拟以自有资金出资1.00亿元在深圳光明区投资设立全资子公司。
审评动向
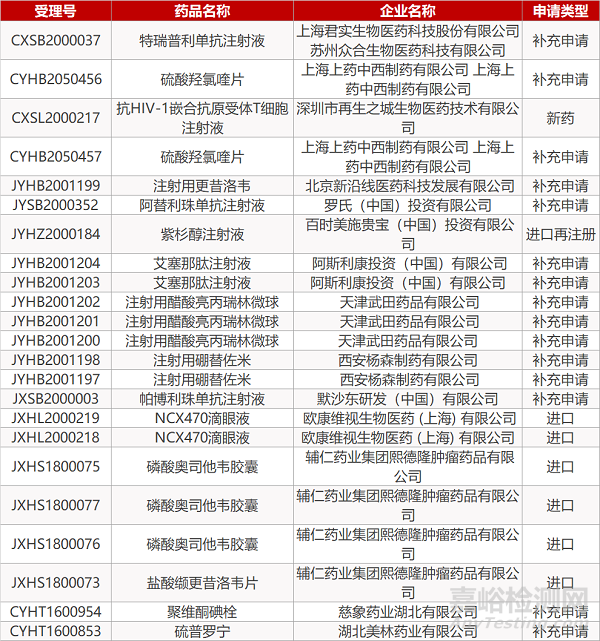
1. CDE最新受理情况(07月30日)

- The End -

来源:药研发


