您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-06-28 14:22
增材制造口腔修复用激光选区熔化金属材料注册技术审查指导原则
(征求意见稿)
为了更好地推动和规范增材制造口腔修复用激光选区熔化金属材料的创新发展,指导注册申请人进行相关医疗器械产品的注册申报,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考,特制定本指导原则。
本指导原则是对增材制造口腔修复用激光选区熔化金属材料注册申报资料的一般要求。注册申请人应当根据材料的特性确定本指导原则各项要求的适用性,并依据产品的特性对注册申报资料的内容进行充实和细化。
本指导原则是对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。应当在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在对现行法规、标准体系,以及当前个性化增材制造医疗器械技术和管理科学认知水平下制定。随着法规和标准的不断完善,以及技术和监管科学的不断发展,监管部门将对本指导原则的内容进行更新和修订。
一、适用范围
本指导原则适用于激光选区熔化(selective laser melting,SLM)增材制造工艺制造口腔固定或活动修复体的金属材料,包括烤瓷或非烤瓷口腔修复体的金属粉末。按照《医疗器械分类目录》及有关的分类界定文件,产品属于目录17口腔科器械,一级产品类别06口腔义齿制作材料,管理类别为Ⅲ类。
本指导原则不适用于采用了其他增材制造工艺或用于口腔修复以外的金属材料、非金属材料。注册申请人可根据产品的具体设计原理、结构及组成特征、性能指标要求和临床应用,参照本指导原则中的相关内容。
二、技术审查要点
(一)产品名称的要求
根据《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)、《医疗器械通用名称命名指导原则》(2019年第99号)相关要求,采用国家标准或行业标准中的通用名称,以产品的技术原理、结构组成或预期用途为依据命名。产品命名应至少包括产品的主要化学成分、适用的加工工艺(激光选区熔化)和临床用途(口腔修复)。
例如:牙科用激光选区熔化钴铬合金粉、增材制造口腔修复用激光选区熔化纯钛金属材料、牙科用激光选区熔化钛合金粉、牙科用激光选区熔化钴铬钼钨烤瓷合金粉。
(二)产品的结构和组成
注册申请人根据GB 17168-2013《牙科学 固定和活动修复用金属材料》、YY/T 1702-2020 《牙科学增材制造口腔固定和活动修复用激光选区熔化金属材料》规定,在综述资料中明确列出产品的化学成分及含量。
(三)产品工作原理/作用机理
增材制造口腔修复用激光选区熔化金属材料利用金属材料良好的理化性能、可加工性能,产品经过激光选区熔化工艺制成口腔修复体。激光选区熔化增材制造打印技术是利用高能量的激光束,按照预定的扫描路径,扫描预先铺覆好的金属粉末,将其完全熔化,再经冷却、凝固后成形的一种技术。
在计算机上利用三维造型软件获得口腔修复模型的三维实体模型,然后通过切片软件对该三维模型进行切片分层,得到各截面的轮廓数据,由轮廓数据生成填充扫描路径。增材制造设备按照路径填充扫描线,控制激光束选区熔化各层的金属粉末材料,逐步堆叠成三维的口腔修复体。如下图1所示,激光束开始扫描前,铺粉装置先把金属粉末平推到基板上,激光束按当前层的填充扫描线,选区熔化基板上的粉末,加工出当前层,逐层加工,直到整个打印件加工完毕。整个加工过程在通有保护气体的加工室中进行,以避免金属在高温下与其他气体发生反应。
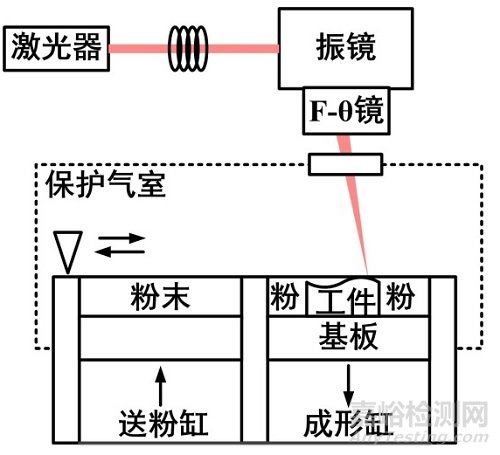
图1 SLM成形原理图
(四)注册单元划分的原则和实例
注册申请人原则上根据产品的结构组成、性能指标划分医疗器械注册单元。产品的结构组成或加工处理方式不同而导致产品性能指标或适用范围不同时,原则上划分为不同注册单元。例如,牙科用激光选区熔化钴铬合金粉、纯钛、钛合金产品划分为不同的注册单元,电极感应熔化气体雾化、等离子惰性气体雾化、真空感应熔化气体雾化、等离子旋转电极雾化加工产品划分为不同注册单元。
(五)产品适用的相关标准
包括但不仅限于表1所列出的相关标准(注:本指导原则中标准适用最新版本,下同)。
表1相关产品标准
|
标准编号 |
标准名称 |
|---|---|
|
GB 17168-2013 |
《牙科学固定和活动修复用金属材料》 |
|
YY/T 1702-2020 |
《牙科学增材制造口腔固定和活动修复用激光选区熔化金属材料》 |
|
GB/T 228.1-2010 |
《金属材料拉伸试验第1部分室温试验方法》 |
|
GB/T 1482-2010 |
《金属粉末流动性的测定标准漏斗法(霍尔流速计)》 |
|
GB/T 1479.1-2011 |
《金属粉末松装密度的测定第1部分:漏斗法》 |
|
GB/T 5162-2006 |
《金属粉末振实密度的测定》 |
|
GB/T 5314-2011 |
《粉末冶金用粉末取样方法》 |
|
GB/T 13810-2017 |
《外科植入物用钛及钛合金加工材》 |
|
GB/T 16886.1-2011 |
《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》 |
|
GB/T 19077-2016 |
《粒度分布激光衍射法》 |
|
GB/T 35021-2018 |
《增材制造工艺分类及原材料》 |
|
GB/T 35022-2018 |
《增材制造主要特性和测试方法零件和粉末原材料》 |
|
GB/T 35351-2017 |
《增材制造术语》 |
|
YY 0621.1-2016 |
《牙科学匹配性试验第1部分:金属-陶瓷体系》 |
|
YY/T 0268-2008 |
《牙科学用于口腔的医疗器械生物学评价第1单元:评价与试验》 |
|
YY/T 0287-2017 |
《医疗器械质量管理体系用于法规的要求》 |
|
YY/T 0316-2016 |
《医疗器械风险管理对医疗器械的应用》 |
|
YY/T 0466.1-2016 |
《医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求》 |
|
ISO 13322-1:2014 |
Particle size analysis — Image analysis methods — Part 1: Static image analysis methods |
|
ISO 13322-2:2006 |
Particle size analysis — Image analysis methods — Part 2: Dynamic image analysis methods |
|
ISO 4490:2018 |
Metallic powders-Determination of flow rate by means of a calibrated funnel (Hall flowmeter) |
|
ISO 22674:2016 |
Dentistry - Metallic materials for fixed and removable restorations and appliances |
|
ASTM E354-14 |
Standard Test Methods for Chemical Analysis of High-Temperature, Electrical, Magnetic, and Other Similar Iron, Nickel, and Cobalt Alloys |
|
ASTM F1877-16 |
Standard Practice for Characterization of Particles |
上述标准为产品技术要求中涉及的常用标准,注册申请人根据申报产品的特点和用途评估标准适用性。注册申请人可以根据产品特点引用适用的其他标准,并说明理由。
(六)产品的适用范围
1.适用范围
增材制造口腔修复用激光选区熔化金属材料通过增材制造激光选区熔化方式,用于制作牙科金属固定和活动修复用的修复体,如冠、桥、卡环、支架等。
适用范围的表述应客观、清晰,使用有明确定义或行业公认的术语或名词,应描述产品适用于制作的修复体类型。
2.禁忌症:
禁忌症应包括该产品不适用的疾病、情况及特定的人群。如:对金属粉末产品中的成分过敏者禁用。
(七)产品的主要风险
注册申请人应按照YY/T 0316-2016《医疗器械风险管理对医疗器械的应用》标准的要求,对原材料采购、生产加工过程、产品包装、运输、贮存、使用等产品生命周期全过程实施风险管理。申请人在产品准备注册上市前,应对风险管理过程进行评审。评审应至少确保:产品的风险已被全面地分析;风险管理计划已被适当地实施;综合剩余风险是可接受的;已有适当方法获得相关生产和生产后信息。风险管理资料应至少包括以下信息:
1.可能影响产品安全性的特征问题清单
注册申请人应参考YY/T 0316-2016附录C的要求判定医疗器械与安全性有关特征的问题,但识别风险的来源并不局限于此。注册申请人应对该类产品进行充分的风险识别,风险识别的信息来源需要具体列出,可包括但不局限于以下途径:类似产品的投诉/抱怨数据、医学文献、实验室检测、产品标签标识、专家观点等。对于风险识别信息的来源企业应具体说明,并提交有关支持文件或文献。
2.产品有关危害的清单
注册申请人应详细列出与产品有关的已知和可预见危害的清单,以及对每个危害如何造成损害的分析(包括可预见的事件序列、危害处境和可能发生的损害)。
注册申请人应指出拟申报产品所特有的任何额外风险,说明风险分析的方法。已识别的风险应至少包括但不局限于以下方面:
(1)材料的生物学和化学危害:
材料的化学结构及来源
材料的生物相容性
(2)生产加工过程可能产生的危害:
污染
添加剂(助剂)的残留
生产环境洁净度
(3)产品使用风险因素:
刺激性、致敏性、功能失效
(4)不正确使用产生的危害:
使用产品时未按照说明书中操作方法操作
忽视说明书中适用范围及禁忌症、警示信息内容
(5)产品包装可能产生的危害:
包装破损
标识不清
与贮存和运输过程不适宜
注册申请人应对所识别的风险提出具体的降低风险的措施。降低所申报产品的风险应依据YY/T 0316-2016要求依次从设计、保护、说明书进行考虑。
注册申请人应在产品生命全周期中对风险进行管理控制,以使剩余风险在可接受范围内。可通过产品设计控制、产品原材料选择、产品技术性能指标的制定、正确的标签标识、生产和检验控制、产品说明书等多项措施以降低风险至可接受水平,但不局限于以上所述。
注册申请人提供产品上市前对其风险管理活动进行全面评审所形成的风险管理报告,此报告旨在说明并承诺风险管理计划已被恰当地实施,并经过验证后判定综合剩余风险是可接受的,已有恰当的方法获得产品设计、制造、出厂后流通和临床应用的相关信息。
风险管理报告应当包括风险分析、风险评价、风险控制等产品风险管理的相关资料,至少应当包括产品安全特征清单、产品可预见的危害及危害分析清单(说明危害、可预见事件序列即危害成因分析)、危害处境和可能发生的损害之间的关系、风险评价、风险控制措施以及剩余风险评价汇总表。
(八)产品的研究要求
应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。研究资料包括但不限于如下内容:
1.金属粉末性能研究
对金属粉末生产工艺(电极感应熔化气体雾化、等离子惰性气体雾化、真空感应熔化气体雾化、等离子旋转电极雾化等)中气体压力、流速和温度,气雾化喷嘴的内径和喷射角度,气雾化塔里的压力和氧含量,旋转电极雾化工艺的电流和转速等关键工艺参数进行研究,对金属粉末的化学成分、有害元素、粉末外观、球形度、粉末粒度及分布、粉末流动性、粉末松装密度、粉末振实密度、固相线和液相线温度或熔点、粉末堆积特性等性能开展研究,关注氧、氢、氮等成分对后续增材制造件的影响,明确各项性能指标的确定依据,提交研究资料说明性能指标的设置合理性和质控稳定性。
2.激光选区熔化增材制造件性能研究
激光选取熔化增材制造件性能反应了金属粉末原材料性能和质量控制水平、金属粉末原材料与打印工艺匹配性能,是评价产品临床使用性能的重要指标。注册申请人应按照口腔修复体的临床使用需要,按申报产品使用修复体类型分别与常规工艺(铸造、切削工艺等)加工的修复体进行性能研究和对比。对激光选区熔化增材制造件的理化性能进行研究,包括化学成分(打印前后变化情况)、表面粗糙度、尺寸、翘曲变形,硬度、拉伸性能、弯曲性能、夹杂物和孔隙率、密度、耐腐蚀性、抗晦暗、显微组织、密合性、线胀系数(如适用)、金属-陶瓷体系性能—剥离/萌生裂纹强度(如适用)等,应对不同打印方向和热处理工艺对性能的影响进行研究。明确各项性能指标的确定依据,提交研究资料说明性能指标的稳定性和合理性。各修复体类型产品最差情况的选择应当根据产品的临床应用特点、修复体结构设计、加工工艺等方面确定,提交研究资料。
3.原材料质控要求
提交原材料质控要求,明确符合的标准或具体技术要求,并提交金属粉末成分和原材料成分差异的研究资料。
4.生物相容性
口腔修复体是与人体表面(口腔粘膜)持久接触的产品,作为口腔修复体激光选区熔化加工的金属原材料,其生物相容性评价应遵循GB/T 16886.1-2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》、YY/T 0268-2008《牙科学口腔医疗器械生物学评价第1单元:评价与试验》及《医疗器械生物学评价和审查指南》(国食药监械﹝2007﹞345号)相关要求,生物相容性评价资料可以考虑(包括但不限于)以下方面:
(1)医疗器械生物学评价的策略和所含程序
(2)医疗器械所用材料选择的描述
(3)材料表征
-医疗器械材料的定性与定量的说明或分析
-医疗器械材料与市售产品的等同性比较
(4)选择或放弃生物学试验的理由和论证
(5)已有数据和试验结果的汇总
(6)完成生物学评价所需的其他数据
具体生物学评价试验项目应参照YY/T 0268-2008《牙科学口腔医疗器械生物学评价第1单元:评价与试验》确定,建议考虑:
细胞毒性
致敏性
急性全身毒性
口腔粘膜刺激或皮内反应
遗传毒性
亚慢性全身毒性
应选用激光选区熔化增材制造件进行生物学试验,并提供生物学评价试验过程中制样方法、制样的质量控制及制样方法确定依据。
5.产品包装和有效期
产品有效期是指产品在一定的温度、湿度、光线等条件的影响下,保持其物理、化学等性能的期限。增材制造口腔修复用激光选区熔化金属材料的有效期验证一般包括产品有效期验证和包装验证。
(1)产品有效期验证:提供产品有效期及有效期验证资料。
产品有效期验证可依据有关适用的国内、国际标准和验证方案进行,提交产品的有效期验证报告。产品有效期可采用实时老化研究、加速老化研究验证。
在有效期研究中,应监测整个有效期内确保产品安全性和有效性的关键参数如在产品技术要求中所描述的参数(如化学成分、粉末粒度及分布、流动性等),并提交所选择测试方法的验证资料。
若选择实时老化有效期验证试验,产品选择的老化环境条件应不低于产品说明书宣称的贮存、运输环境条件。
若选择加速老化有效期验证试验,应说明所用加速条件的合理性。例如,在标准温度和升高温度情况下的降解机制应该是等效的,即温度改变而Arrhenius曲线的斜率保持不变。在不能证实等效性时,即不同温度下可由不同机制引起产品失效,应提交额外的合理性说明。在进行加速老化试验研究时应注意:产品选择的环境条件的老化机制应与宣称的贮存、运输环境条件下产品老化的机制相匹配。
(2)包装验证:在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。
产品包装验证可依据有关适用的国内、国际标准和验证方案进行,如:产品包装的跌落试验、振荡试验、极端温度试验、极端湿度试验等,提交产品的包装验证报告。包装材料的选择建议考虑以下因素:包装材料的物理化学性能;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料所能提供的物理、化学保护;包装材料与标签系统的适应性;包装材料与贮存运输过程的适合性。包装验证的资料内容应与包装说明中给出的信息相符。对于不适用的因素应阐述不适用的依据。
对于包装的有效期验证,建议申请人提交最终产品初包装的初始完整性和维持完整性的验证结果。
6.其他研究实验
6.1金属粉末与打印参数匹配性研究
应开展金属粉末与打印设备关键工艺参数的匹配性研究,关键工艺参数包括激光功率、扫描速度、光斑直径、扫描间距、扫描策略、铺粉厚度、气氛保护、支撑结构、打印方向、成形室温度等,明确金属粉末性能最差情形和打印工艺的参数设置区间。可采用推荐的打印工艺进行加工,对加工过程和成形件性能进行评价,最终成形件性能应满足产品技术要求。
6.2粉末循环使用性能研究
若申报产品可回收循环使用,应当对打印设备关键工艺参数要求、粉末循环使用与金属粉末化学成分和物理性能(金属粉末流动性、粒径、氧氮量等)、成形件的化学成分和物理性能(拉伸性能、弯曲性能、夹杂物和孔隙率等)的影响进行研究,提交金属粉末打印后筛分和混粉工艺研究资料,应明确推荐的粉末循环使用的次数和循环使用要求(筛分、混粉工艺要求)。
6.3热处理工艺研究
验证资料包括热处理方法适宜性验证和评估;热处理参数确定的依据;热处理后结果的可接受性准则。
通过热处理工艺验证,包括升温时间、保温温度、保温时间等热处理参数的确定依据,明确申请注册产品推荐的热处理工艺。
6.4疲劳及摩擦磨损性能研究
根据注册产品的适用范围,制定相应的疲劳及摩擦磨损实验。若产品适用于制作固定义齿,应开展牙桥连接体的疲劳试验及牙冠牙合面摩擦磨损试验;若产品适用于制作活动支架,应开展卡环及大连接体的疲劳试验及基牙牙冠牙合面摩擦磨损试验。可根据产品适用的标准要求确定需要的功能试验项目、试验方法。
测试中应尽量模拟义齿修复体在临床中的实际使用情况,考虑其疲劳和抗反复弯折的能力。
实验应进行合理分组,可设置同种材料的铸造合金产品、锻造合金产品作为对照组,进行性能比对。
(九)产品技术要求的主要性能指标
产品技术要求应当按照《医疗器械产品技术要求编写指导原则》(国家食品药品监督管理总局通告2014年第9号)进行编写。同时结合YY/T 1702-2020《牙科学增材制造口腔固定和活动修复用激光选区熔化金属材料》以及产品特点,明确保证产品安全、有效、质量可控的各项性能指标和检验方法。
产品技术要求中指标应当针对金属粉末和激光选区熔化增材制造件制定,且性能指标不应当低于产品适用的强制性国家标准和/或强制性行业标准,检验方法应当优先考虑采用公认的或已颁布的标准检验方法,包括推荐性标准,应当注明相应标准的编号和年代号。
具体指标包括但不限于以下内容:
1.金属粉末
1.1化学成分
(1)主要元素:标明大于1.0%(质量分数)的成分含量,精确至0.1%,明确对氧、氢、氮等影响产品性能的成分含量要求。0.1%~1.0%之间的成分需标出名称或符号;
(2)允许成分偏差;
(3)有害元素:需要指出含量;
1.2物理性能:粉末外观、球形度、粉末粒度及分布、粉末流动性、粉末的松装密度、粉末的振实密度、固相线和液相线温度(合金)或熔点(商业用纯金属)。
2.激光选区熔化增材制造件
2.1物理性能:表面粗糙度、尺寸、翘曲变形、密度、夹杂物和孔隙率;
2.2机械性能:硬度、拉伸性能、弯曲性能;
2.3化学性能:耐腐蚀性、抗晦暗、化学成分;
2.4金瓷结合:仅适用于金属-烤瓷修复体用金属材料,如线胀系数、剥离/萌生裂纹强度
(十)同一注册单元内注册检验典型性产品确定原则和实例
同一注册单元内,典型产品作为被检测的产品,是指能够代表本注册单元内其他产品安全性和有效性的产品,增材制造口腔修复用激光选区熔化金属材料的注册检验典型型号产品应选择能够覆盖注册单元内全部产品。
(十一)产品生产制造相关要求
应当明确粉末的生产加工工艺,注明关键工序和特殊过程,并阐明其过程控制点及控制参数,并对生产工艺的可控性、稳定性进行确认。有多个研制、生产场地,应当概述每个研制、生产场地的实际情况。
在产品生产制造相关信息中提供增材制造口腔修复金属材料制备工艺的工作原理、工艺的优缺点,明确粉末制备关键工序和特殊过程并提供研究资料。应当对制粉使用的原材料,关键工艺参数,控制流程,微量元素、污染源等方面进行质量控制,建立完善的制粉工艺流程及关键工艺步骤和质量控制方法,并验证关键工艺参数对金属粉末质量(化学成分、颗粒形貌和粒径分布)的影响。
同时,还应提供金属粉末筛分、混合和分装的工艺流程。阐述各步骤的工艺控制方法,特别针对超细粉末的筛分过程中的去除情况、气氛保护和污染防控进行描述。
(十二)产品的临床评价要求
注册申请人应按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号),选择合理的临床评价方式,提交临床评价资料。进口医疗器械还应提供境外政府医疗器械主管部门批准该产品上市时的临床评价资料。
1.列入《免于进行临床试验的医疗器械目录》产品的临床评价要求
依据《关于公布新修订免于进行临床试验医疗器械目录的通告》(国家药品监督管理局通告XXXX年第XX号),属于“XXXX”目录范围内的产品,可免于进行临床试验。注册申请时需提交临床评价资料要求:
(1)申报产品相关信息与《目录》所述内容的对比评价资料;
(2)申报产品与《目录》中已获准境内注册医疗器械的对比评价资料,包括《申报产品与目录中已获准境内注册医疗器械对比表》及差异部分不会对产品安全有效性产生不利影响等相应支持性资料。
提交的上述资料应能证明申报产品与《目录》所述的产品具有等同性。若无法证明,则应按照《医疗器械临床评价技术指导原则》其他要求开展临床评价。
2.通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价要求
按照《医疗器械临床评价技术指导原则》相关要求开展临床评价。
3.临床试验基本要求
在中国境内开展临床试验的应符合《医疗器械临床试验质量管理规范》(国家食品药品监督管理总局中华人民共和国国家卫生和计生委员会令第25号)的要求。应对产品是否满足使用要求或者适用范围进行确认。提交的临床评价资料应当包括临床试验协议、临床试验方案和临床试验报告等。
如提交境外临床试验数据,应符合《接受医疗器械境外临床试验数据技术指导原则》(国家食品药品监督管理总局通告2018年第13号)相关要求。
(十三)产品的不良事件历史记录
注册申请人应当按照《医疗器械不良事件监测和再评价管理办法》有关规定开展不良事件监测工作,按要求收集、记录、提交产品相关的不良事件历史记录。
(十四)产品说明书和标签要求
产品说明书、标签和包装标识应当符合《医疗器械说明书和标签管理规定》要求,还应当符合相关国家标准、行业标准的要求,例如YY/T 0466.1—2016《医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求》。
除已批准信息外,说明书和标签中应当明确产品的热处理条件,打印机的重要参数推荐范围如:铺粉层厚、光斑直径、激光功率、扫描速度、打印间距等,金属粉末重复使用次数及使用处理方法,在金属粉末使用过程中预防粉尘吸入的建议及其他需要补充的信息。
三、审查关注点
1.母合金化学成分及选材依据研究资料,金属粉末性能研究资料、生产加工工艺质控稳定性和关键控制点;
2.金属粉末特性与打印参数、后处理方法匹配性研究,激光选区熔化增材制造件性能研究资料(疲劳、磨损、耐腐蚀、金瓷结合性能等);
3.产品性能研究资料是否能支持宣称的适用范围。
4.注册证中的结构与组成应标识含量大于1.0%(质量分数)的元素名称或符号。

来源:国家药监局