您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-01 11:09
1、摘要
强制降解试验属于药物稳定性研究内容之一,也是药物开发研究的一部分,有助于揭示药物的稳定特性和可能降解途径,对于分析方法的开发和验证也具有重要意义。本文是笔者对原料药强制降解试验理论的总结,供广大读者在工作闲暇之处讨论,不足之处还望理解。
2、原料药强制降解试验的目的
强制降解试验是指将原料药置于剧烈的试验条件下,考察其稳定性的一系列试验。试验目的主要有:一是通过试验了解该原料药内在的稳定特性及其降解途径与降解产物。例如,通过酸降解试验,可以了解所考察的药品在酸性条件下是否稳定;如果不稳定,大致在何种条件下不稳定,该药品又是通过何种降解途径得到何种降解产物;二是为包装材料选择提供信息;三是对原料药有关物质分析方法进行专属性验证;四是为储存条件提供信息。
典型的强制降解主要包括四种机制:高温、水解、氧化和光降解。
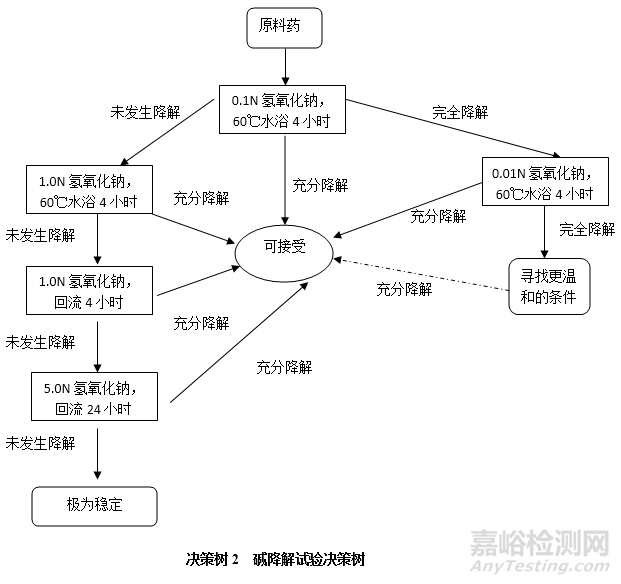
碱降解试验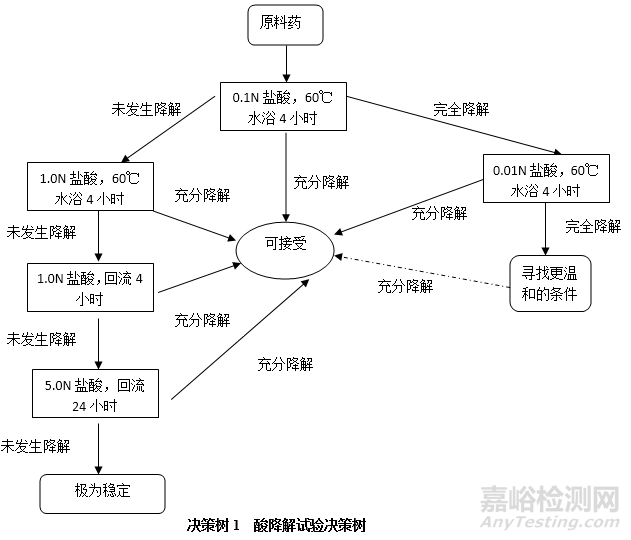
氧化降解试验
热降解试验
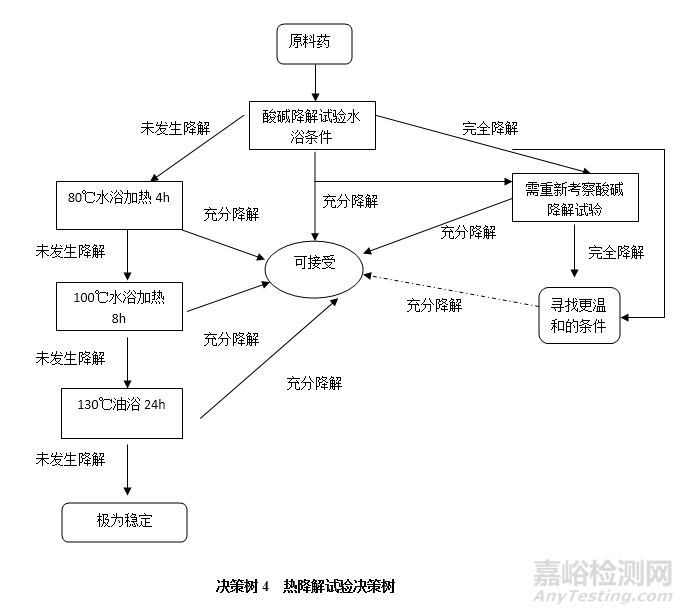
热降解试验一般情况下是在优先进行酸碱降解试验的水浴加热条件,根据试验结果逐步提高加热温度。其是符合阿伦尼斯方程的,即降解速率随着温度的升高而加快。通常还可结合高湿度条件进行。可按决策树4进行试验。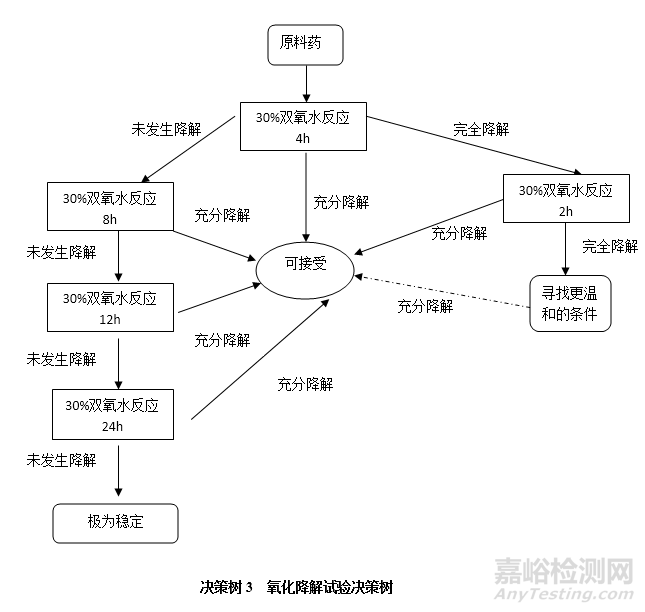
光降解试验
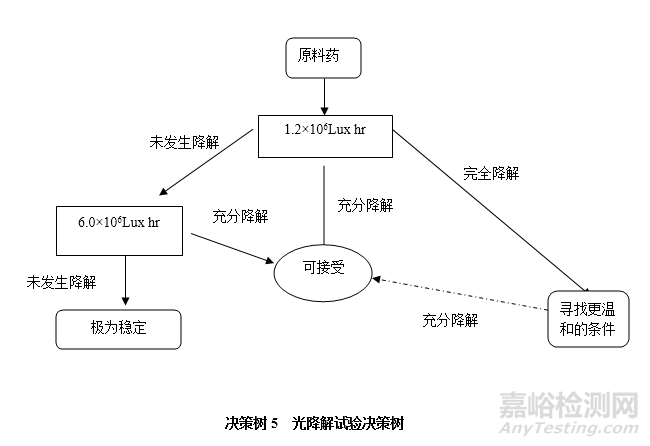
3、降解试验样品设计
在进行强制降解试验时,所需的样品浓度应至少为1.0mg/ml。对于水溶性较差的原料药可以采用少量甲醇混合溶解的方式达到预期样品浓度。而原料药经过酸、碱、氧化降解破坏后,一般含有较高的残留的反应剂,应该对破坏后的样品采用中和法或稀释法进行前处理,避免损坏仪器和色谱柱。
一般来说一种降解条件需要制备4份样品进行对比试验:常规条件的空白溶液、常规条件的供试品溶液、降解条件下的空白溶液和降解条件下的供试品溶液。在进行降解试验过程中,间隔取样可以识别一级产物和二级产物。
4、降解试验终点
每个降解条件都应规定一个合格的反应终点,从而达到最优破坏水平,也就是决策树中所说的充分降解。对于原料药的强制降解试验,一般以主成分降解5%~20%为宜;对于要求含量为标示量的90.0%~110.0%的原料药,破坏程度应不超过主成分的10%。
5、降解试验结果判定
对于降解破坏后的含量大于0.1%的未知杂质,应该对于进行结构确证。并且所用分析方法应该使含量大于0.1%的未知杂质的分离度符合要求或者满足定性要求。采用DAD或PDA检测器的峰纯度功能可以判断主成分是否掩盖了降解破坏后生产的杂质。同时经各降解条件破坏后的样品应该达到质量守恒,对于潜在损失、非紫外吸收、强极性杂质和极弱极性杂质都应该被考虑。
6、仿制药和创新药的强制降解试验
对于创新药应该早期开展强制降解试验,设计比较全面的强制降解试验,充分了解稳定性特征,为制剂处方、工艺的设计、以及产品的储存条件的确定提供帮助。在各种降解试验中应设立多种破坏程度,原料药可以分别在固体和溶液状态分别进行强制降解试验。
对于仿制药来说,如果已有充分的文献资料对该药的稳定性及其降解途径与降解产物进行比较全面的阐述,则没有必要进行强制降解试验。同一个原料的不同晶型可能具有不同的稳定性特征,当一个仿制药产品的晶型不同于原研产品晶型时,应该进行多晶型稳定考察试验。仿制药的光降解试验不论结果怎样,其说明书都必须与原研保持一致。
7、结语
原料药的强制降解试验应该基于QbD原则,一个精心设计的强制降解试验研究对于分析方法的开发是不可或缺的,它有助于建立一个稳定的特异性指示方法和预测在稳定性研究中的可能形成的潜在降解产物。同时,强制降解试验可提供原料药的物理、化学稳定性方面的信息,为包材、储存条件的选择提供依据。
参考文献
【5】FDA Perspectives: Scientific Consideration of Forced Degradation Studies in ANDA Submission

来源:ZMJ/药事纵横


