您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-24 08:47
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
拜耳“广谱”抗癌药larotrectinib获欧盟批准。拜耳口服TRK抑制剂larotrectinib获欧盟委员会批准,用于治疗局部晚期、远端转移、无法手术切除或手术疗效欠佳的且无满意替代治疗方案的神经营养性受体酪氨酸激酶(NTRK)基因融合的成人和儿童实体瘤患者。larotrectinib是欧盟首个批准的不区分肿瘤类型用于治疗具有NTRK基因融合的抗癌药物。此次获批是基于102例患者临床试验数据的汇总分析,larotrectinib在NTRK融合的成人和儿童肿瘤患者中,包括中枢神经系统(CNS)肿瘤中均显示出高效和持久的应答。目前该药已在美国、巴西和加拿大获批。
国内药讯
1.默克西妥昔单抗新适应症在华审批完毕。默克西妥昔单抗(爱必妥)的第二项适应症上市申请审批状态更新为"审批完毕-待制证"。继2005年爱必妥获国家药监局批准转移性结直肠癌适应症之后,爱必妥的新适应症极有可能为RAS野生型转移性结直肠癌一线治疗。爱必妥是靶向表皮生长因子受体(EGFR)的IgG1单克隆抗体。一项Ⅱ期OPUS试验分析数据显示,西妥昔单抗联合FOLFOX一线治疗KRAS野生型转移性结直肠癌患者获得良好的疗效。另一项临床CRYSTAL研究结果也显示,西妥昔单抗联合FOLFIRI一线治疗野生型患者可将疾病进展危险度下降32%。
2.恒瑞公布卡瑞利珠单抗治疗食管鳞癌的研究成果。恒瑞医药在CSCO大会上公布其PD-1抗体卡瑞利珠单抗治疗食管鳞癌的研究成果。在Ⅲ期研究ESCORT中,与多西他赛或伊立替康相比,卡瑞利珠单抗单药治疗将既往接受一线化疗失败的晚期/转移性食管鳞癌患者的总生存期(OS)显著提高,达主要终点。在评估卡瑞利珠单抗联合阿帕替尼和化疗(紫杉醇脂质体+奈达铂)一线治疗晚期食管鳞癌的Ⅱ期临床中,卡瑞利珠单抗联合疗法的客观缓解率达80%,疾病控制率达96.7%,且不良反应可控、可预期。
3.君实生物PD-1多瘤种布局取得新突破。君实生物在CSCO大会上公布其PD-1抗体特瑞普利单抗治疗膀胱尿路上皮癌和非小细胞肺癌(NSCLC)两项Ⅱ期研究成果。在评估特瑞普利单抗单药治疗经标准治疗失败后的晚期局部进展或转移性膀胱尿路上皮癌患者的POLARIS-03研究中,截至2019年9月5日,特瑞普利单抗的客观缓解率(ORR)为26.4%,疾病控制率(DCR)为50.9%,缓解持续时间(DOR)为9.03周。PD-L1阳性患者ORR达42.4%。在评估特瑞普利单抗联合化疗(培美曲塞、卡铂)治疗EGFR突变阳性NSCLC的临床研究中,特瑞普利单抗联合方案的ORR为50%,DCR为87.5%,DOR为7.0个月,整体人群的中位PFS为7.0个月。其中PD-L1阳性患者的ORR为60%,中位PFS达8.2个月。
4.葆元医药公布ROS1/NTRK双靶点抑制剂AB-106 研究成果。葆元生物在CSCO大会上公布其新一代ROS1/NTRK双靶点抑制剂AB-106研究成果。在评估AB-106治疗ROS1阳性非小细胞肺癌的I期临床中,在18例可评估患者中,AB-106可使克唑替尼未治疗组的ORR达66.7%,DCR达100%,PFS为24.9月;可使经克唑替尼治疗组的ORR达33.3%,DCR达77.8%,PFS为7.6月;AB-106显示良好的耐受性和安全性。此外,在美国的I期临床中,有1例NTRK1融合基因阳性的甲状腺癌患者经AB-106治疗后达到PR,疗效持续,目前患者已治疗了35个月,仍在观察随访之中。
5.荣昌生物公布HER2抗体偶联药物两项研究成果。荣昌生物在CSCO大会上公布其新型HER2抗体偶联药物RC48-ADC的两项研究数据。在评价RC48-ADC治疗HER2阳性晚期乳腺癌的I/Ib期临床中,RC48-ADC显示出良好的疗效和可控的安全性;1.5mg/kg剂量开始出现肿瘤应答,2.0mg/kg及2.5mg/kg治疗效果显著;RC48-ADC的安全性特点主要为轻中度的肝功能毒性等。在评估RC48-ADC治疗HER2阳性局部晚期或转移性尿路上皮癌患者的II期临床中,独立影像学评估的ORR为51.2%(95%CI: 35.5%, 66.7%),DCR为90.7%。整体中位PFS为6.9个月(95%CI 5.3~8.3),存在内脏转移患者ORR为56.8%,既往接受过免疫治疗患者的ORR为75.0%等,无特殊不良反应发生。
6.舒泰神STSG-0002注射液获批临床。舒泰神旗下国家I类治疗用生物制品STSG-0002注射液获国家药监局临床批件,STSG-0002注射液拟开发适应症为慢性乙型肝炎。STSG-0002注射液为携带靶向HBV基因组P区和X区的shRNA序列表达框的肝噬性复制缺陷重组腺相关病毒,该疗法采用重组腺相关病毒(rAAV)作为递送载体。在采用HBV转基因小鼠模型进行的临床前有效性研究中,STSG-0002注射液表现出良好的有效性和长效性,在降低HBV相关抗原方面较已有的NAs类药物恩替卡韦表现出明显优势。目前全球范围内尚无该靶点基因药物上市销售。
国际药讯
1.安斯泰来/珐博进宣布roxadustat在日本获批。安斯泰来与珐博进联合开发的首创HIF-PH抑制剂Evrenzo(roxadustat,罗沙司他)在日本获批用于正在接受透析的患者治疗慢性肾脏病(CKD)相关贫血。4项III期(1517-CL-0302,-0307,-0308,-0312)结果显示,在接受透析的CKD贫血患者中,roxadustat能够有效地提高血红蛋白水平,并具有很好的耐受性。Roxadustat由珐博进发现,安斯泰来通过授权获得其在日本、欧洲等市场的商业化许可权。roxadustat去年12月已在中国获得全球首批,用于CKD透析患者的贫血治疗。今年8月,该药在中国获批新的适应症,用于非透析依赖性慢性肾脏病(NDD-CKD)患者的贫血治疗。
2.安斯泰来靶向抗癌药Xospata获CHMP推荐批准。安斯泰来公司第二代FLT3抑制剂Xospata(gilteritinib)获欧洲药管局(EMA)人用医药产品委员会(CHMP)推荐批准,用于治疗携带FLT3突变的复发/难治(药物难治)急性髓性白血病(AML)成人患者。一项ADMIRAL临床研究结果显示,口服Xospata可使患者的CR/CRh(完全缓解率/伴部分血液学恢复的完全缓解)达21%、CR/CRh的中位缓解持续时间达4.6个月。基线期后56天,从依赖输血向不依赖输血的转化率达31.1%。该药在日本已获批用于FLT3突变阳性复发/难治AML成人患者。
3.Aerie青光眼药物Rhokiinsa获欧盟CHMP推荐批准。Aerie公司首创Rho激酶抑制剂Rhokiinsa(netarsudil眼科溶液,0.02%)获欧盟人用医药产品委员会(CHMP)推荐批准,用于原发性开角型青光眼或高眼压成人患者,降低过高的眼内压(IOP)。Rocklatan由固定剂量的拉坦前列素(latanoprost)和netarsudil组成。两项III期研究(MERCURY 1,MERCYRY 2)结果显示,Rocklatan达主要疗效终点以及12个月的安全性和疗效结果。Rocklatan治疗组有超过60%的患者实现IOP降低30%或更多,这一比例大约是拉坦前列素组的2倍。Rocklatan组达到≤16mmHg和14mmHg的患者比例分别是拉坦前列素组的近2倍和近3倍。2017年12月Rhokiinsa已获FDA批准用于开角型青光眼或高眼压患者降低IOP。
4.vTv 口服葡萄糖激酶活化剂TTP399Ⅱ期临床新数据。vTv 公司公布其肝选择性葡萄糖激酶(glucokinase,GK)激动剂TTP399用于辅助治疗1型糖尿病患者的Ⅱ期临床Simplici-T1试验的新数据。数据表明,与对照组相比,TTP399组患者血糖水平处于目标范围内的时间比治疗前基线每天增加了11%(2.7小时),而且在重要的清醒时间段(早7点到晚9点)正常血糖时间增加了12%(1.7小时);在血糖控制显著改善的同时,TTP399治疗组每日注射胰岛素剂量减少23%,而对照组这一数值为4%;TTP399组患者的1级(54-70 mg/dl)和2级(<54 mg/dl)低血糖事件更少。
5.Regeneron/赛诺菲抗炎药Dupixent发表两项Ⅲ期临床结果。Regenerong公司与赛诺菲联合开发的IL-4/IL-13双特异抑制剂Dupixent(dupilumab)治疗鼻息肉慢性鼻窦炎(CRSwNP)的两项Ⅲ期临床研究(LIBERTY NP SINUS-24和LIBERTY NP SINUS-52)获积极结果。724例CRSwNP成人患者(先前已接受手术或全身性皮质类固醇治疗)参与这两项试验,结果显示,Dupixent与皮质类固醇鼻腔喷雾剂联用可缩小患者的鼻息肉,显著降低鼻充血严重程度,达两项试验的相同主要终点;Dupixent可减轻患者的其它慢性鼻窦炎症状,改善患者的嗅觉;与安慰剂相比,Dupixent降低74%的皮质类固醇使用需求以及83%的手术需求;在同时患有哮喘的患者中,Dupixent显示出对肺功能的改善以及对哮喘发作的控制;Dupixent具良好的安全性。
医药热点
1.130家药企研发投入批露。上市公司2019年上半年业绩报告已披露完毕,据不完全统计,A股及港股上市药企中,研发投入超过3000万元的企业共有130家。130家药企上半年研发投入合计约248.4亿元,其中有52家药企研发投入超过1亿元,百济神州、中国生物制药、恒瑞、复星4家药企研发投入均超过10亿元;104家药企研发投入同比去年有增长;32家研发投入占营业收入比重超过10%,TOP5企业均为港股上市药企,分别为信达生物-B、百济神州、君实生物-B、歌礼制药-B、金斯瑞生物科技。
2.中国食管癌精准防治策略研究新进展。美国胃肠病学会(AGA)官方学术期刊《Clinical Gastroenterology and Hepatology》在线发表了北京大学肿瘤医院柯杨教授团队题为“Absence of Iodine Staining Associates with Progression of Esophageal Lesions in a Prospective Endoscopic Surveillance Study in China”的研究论文。该研究首次构建了食管病变进展的个体化风险预测模型,证明了内镜下“碘染色异常特征”对早期低级别病变进展为高级别恶性病变的重要预警价值。
3.我国将建国家儿童肿瘤监测体系。国家卫健委近期正式批复同意国家儿童医学中心(北京儿童医院)设置国家儿童肿瘤监测中心,建立儿童肿瘤登记与监测体系,开展全国儿童肿瘤监测工作。国家癌症中心2000年~2010年统计数据显示,每年儿童肿瘤新发病例约2.2万人,近10年来,0~14岁儿童肿瘤发病率年均增长达2.5%。发达国家儿童肿瘤5年生存率超过83%,我国这一数据为71.9%。目前,国家儿童肿瘤监测中心已开始成立专家组并建立监测平台,预计2021年将全面开展工作。
【京新药业】拟与山东省潍坊滨海经济技术开发区管委会签订招商引资合同,在山东省潍坊滨海经济技术开发区绿色化工园投资新建医药健康全产业链生产基地(原料药、医药中间体为主),项目总用地面积约1000亩,总投资约40亿元,分期、分阶段实施。
审评动向
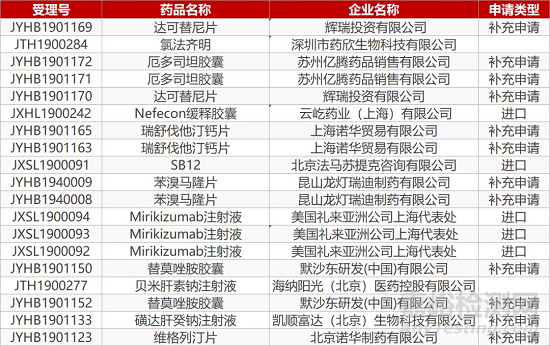
1. CDE最新受理情况(09月23日)
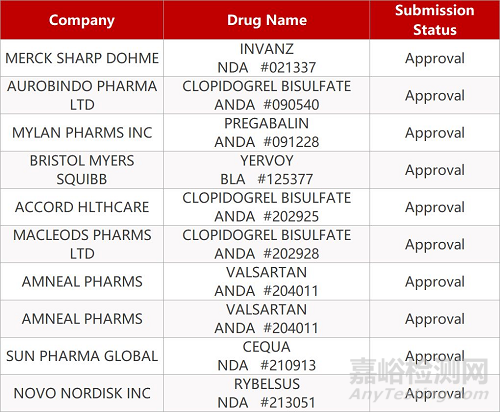
2. FDA最新获批情况(北美09月22日)

来源:药研发


