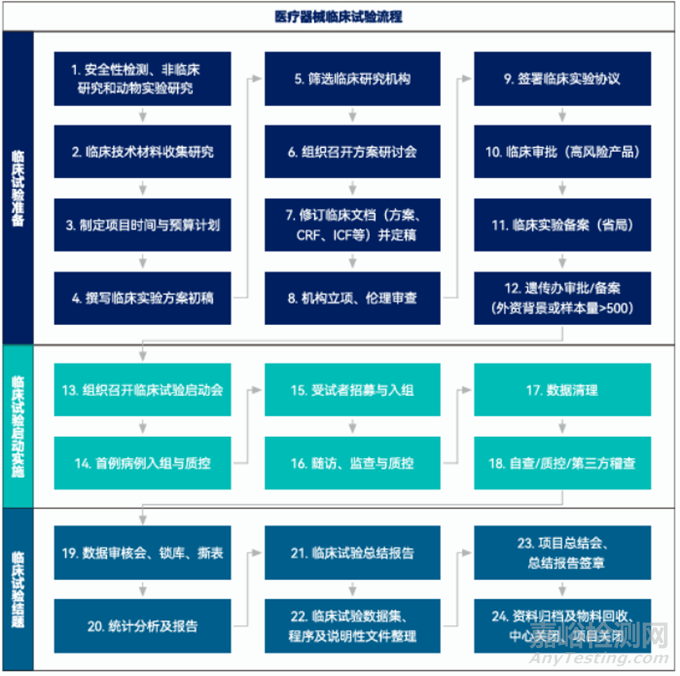
医疗器械临床试验是基于“医疗器械临床试验质量管理规范”(行业也称医疗器械GCP)及相关法规开展的以验证医疗器械产品的安全性和有效性的研究活动。医疗器械临床试验主要包括临床试验准备阶段、临床试验实施阶段和临床试验结题阶段三个阶段,本文从医疗器械临床试验流程中各节点主要工作进行了解析。
阶段一、临床试验准备
1.医疗器械临床前安全性验证
医疗器械临床试验前需先通过安全性验证,包括产品检测、动物实验及其它非临床研究。
2.临床技术资料收集研究
3.制定项目时间和预算计划
4.撰写临床试验方案初稿
5.临床试验机构筛选
医疗器械临床试验应在已备案的医疗器械临床试验机构中开展。
6.组织召开方案研讨会
7.修订临床文档(方案、CRF、ICF、IB等)并定稿
8.立项和伦理审查
9.与临床试验机构签署临床研究协议
10.涉及高风险医疗器械,临床试验前应申请临床试验审批
11.省局备案临床试验
12.涉及外资背景的申办方或CRO或样本量大于500的还应申请人类遗传资源备案或审批
阶段二:临床试验启动实施
13.组织召开临床试验启动会
14.首例入组并完成质控
15.受试者招募与入组
16.随访、监查与质控
17.入组结束,数据清理
18.数据自查、质控或第三方稽查
阶段三:临床试验结题归档
19.数据审核、锁库,必要时召开数据审核会
20.统计分析及报告
21.临床试验小结及总结报告
22.临床试验递交数据整理,包括原始数据集、分析数据集、程序代码和说明性文件等
23.项目总结会,报告签章
24.资料归档及物料回收,项目关闭及中心关闭