Vertex Pharmaceuticals今日宣布,其和CRISPR Therapeutics联合开发的CRISPR/Cas9基因编辑疗法Casgevy(exagamglogene autotemcel,exa-cel)获美国FDA批准,用于治疗12岁及以上输血依赖性β地中海贫血(TDT)患者。这项批准较FDA预定的PDUFA日期提早了约一个半月。Casgevy在2023年12月获美国FDA批准上市,用于治疗12岁及以上镰刀型细胞贫血病(SCD)患者。
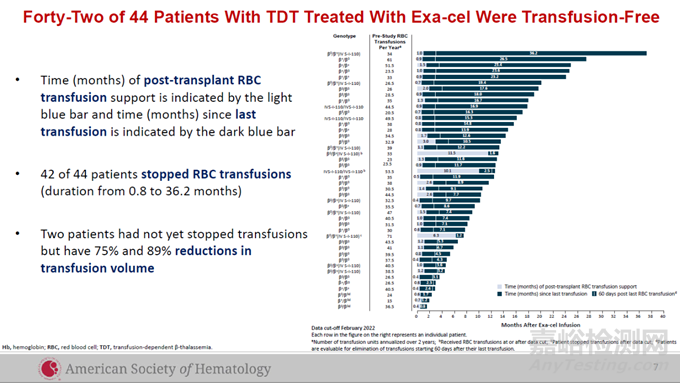
在Casgevy用以治疗TDT患者的全球临床试验中,试验达到主要终点,即患者至少连续12个月不需进行输血,显示Casgevy具有一次治疗,提供功能性治愈的潜力。此前公布的试验结果显示,在接受治疗的44名TDT患者中,42名在随访时间为1.2-37.2个月时,不再需要接受输血,剩余两名患者接受的输血水平分别降低75%和89%。
▲接受Casgevy治疗的TDT患者的临床试验数据(图片来源:CRISPR Therapeutics公司官网)
在这些正在进行的研究中,迄今为止接受Casgevy治疗的97例患者的安全性特征与白消安清髓性预处理和造血干细胞移植基本一致。
▲接受Casgevy治疗患者的安全性试验数据(图片来源:CRISPR Therapeutics公司官网)
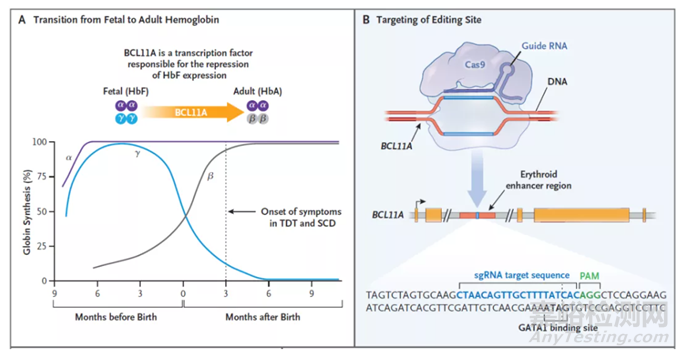
Casgevy是一款非病毒、自体细胞疗法,它利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行编辑,使血红细胞生产高水平的胎儿血红蛋白(HbF)。HbF是携带氧气的血红蛋白的一种形式,在出生时自然存在,随着婴儿的长大,血液中的血红蛋白转换为成人形式的血红蛋白。通过Casgevy治疗,可以提高HbF水平,有可能缓解输血依赖性β地中海贫血患者的输血需求,并减少镰刀型细胞贫血病患者的疼痛和使人衰弱的血管闭塞性危象。
2023年11月,Casgevy获英国药品和健康产品管理局(MHRA)有条件上市许可,用于治疗12岁及以上SCD与TDT患者,成为全世界首款获批上市的CRISPR基因编辑疗法。
▲Casgevy的作用机制:A,BCL11A是下调胎儿血红蛋白表达的转录因子;B,Casgevy通过对BCL11A进行基因编辑,上调胎儿血红蛋白的表达(图片来源:参考资料[2])
2015年,Vertex公司和CRISPR Therapeutics达成战略研究合作,专注于利用CRISPR/Cas9发现和开发针对人类疾病潜在遗传原因的潜在新治疗方法。根据修订后的合作协议,Vertex公司正领导Casgevy的全球开发、制造和商业化。
参考资料:
[1] Vertex Announces US FDA Approval of CASGEVY™ (exagamglogene autotemcel) for the Treatment of Transfusion-Dependent Beta Thalassemia. Retrieved January 16, 2024 from https://news.vrtx.com/news-releases/news-release-details/vertex-announces-us-fda-approval-casgevytm-exagamglogene
[3] Frangoul et al., (2020). CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. NEJM, DOI: 10.1056/NEJMoa2031054.