对于皮肤局部外用药物,目前还没有特定的指导原则。美国EPA和OECD倒是出过一些可能会在人体局部暴露的化学品的指南。但是,这些指南重点提及的是体外毒性测试和啮齿类毒性研究,并未涉及非啮齿类动物试验。
当然,通用的指导原则也是可以用来指导皮肤外用药物安评的。
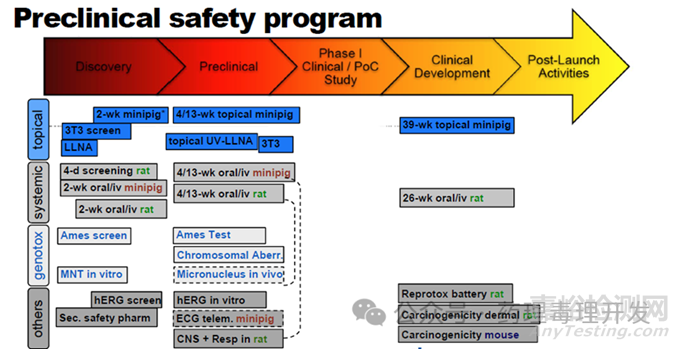
Novartis之前分享过局部用药的临床前安全性评价的研究计划。IND之前以啮齿类+非啮齿类的局部、系统短期重复给药、遗传毒性、安全药理等为主,临床期间补充更长周期一般毒理研究、生殖毒及致癌性试验。从药物发现到IND enabling、支持更长周期临床或上市的研究示意图如下:
纵观皮肤外用制剂的非临床研究内容,除参考传统口服给药制剂的思路设计试验外,在一般毒、致癌、PK部分需要额外考察皮肤外用引入的风险。涉及系统给药这部分比较传统的设计相对常规、多见,不再展开。重点介绍下皮肤外用相关的特殊考量点。
为什么小型猪是皮肤外用制剂的最常用种属,而不是犬或者猴?
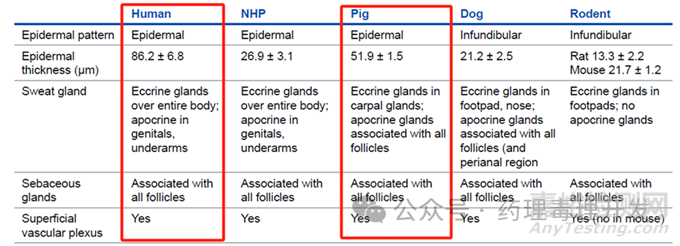
如下图所示,小型猪在表皮特征、厚度、汗腺分布、皮脂腺、浅表血管丛等方面与人体更为接近。在皮肤代谢、生理学(如皮肤渗透)等方面与人体也较非人灵长类或犬更为接近。兔子之前也被用于药物的皮肤毒性评价,但目前已经很少使用,因其皮肤的解剖和生理学特点与人体相关性较差,往往会过度高估毒性。因此,小型猪是皮肤外用制剂的首选非啮齿类研究种属。常用的小型猪的种系主要包括the Sinclair (Hormel), the Yucatan, the Hanford, the Göttingen. 从皮肤颜色、体重增长速率等角度考量,the Göttingen是最常用的种系,且随着使用的增加,该种系逐渐积累了丰富的历史对照背景数据,得到了进一步推广,有点类似滚雪球效应。
小型猪一般毒理研究的试验方案设计关注点
1、剂量设计、给药频率
剂量设计可以参考ICH M3,应该达到人体暴露量的数倍。理想的情况是,低剂量未出现系统毒性、未出现局部毒性或轻微局部毒性。高剂量则建议出现一定的系统毒性,伴随或不伴随轻微的局部毒性。FDA建议将皮肤刺激性试验伴随在一般毒理试验中开展。需要重点提醒的是,由于注射部位空间大小、高浓度制剂制备难度等条件限制,高剂量通常用MFD(Maximum feasible dose)剂量。MFD确定通常需要先开展预试验,在给药部位以0.5mL/kg的体积先进行覆盖,假如这一体积无法完整覆盖给药部位,则可以再增加0.5mL/kg的体积,最多累积到2mL/kg,但通常0.5-1mL/kg操作可行性较高。另外,不同剂量之间,通常给药体积相同,通过调节给药浓度实现不同给药剂量的药物递送。
给药频率和暴露持续时间要视临床拟用暴露量而定。通常是每天用药1次,也偶见2次或更高频率。大多数情况,药物需要持续暴露,也有间歇暴露情况,比如只暴露4-6h。这种情况需要将皮肤表面的药物按时清除。
2、给药部位
小型猪的给药部位通常在背部区域脊柱两侧的位置。给药部位面积至少要达到体表面积的10%。为实现这一给药体积,从肩胛骨到髋骨的区域,以及动物两侧侧面的一半,都应该剃光。
小型猪体表面积计算公式:10%体表面积=70*(公斤体重)0.75
经计算后,10、12kg的小型猪的体表面积分别为394、451cm2
给药前需要对小型猪的毛发进行修剪和必须的剔除,并注意避免伤害到皮肤。如果是用于伤口治疗的药物,则需要用手术刀根据要求制造伤口。关于这部分,FDA有具体指南要求,可以参考A specific FDA Guidance for Industry discusses considerations for evaluation of chronic cutaneous ulcer and burn wounds。
下一步就是将药物均匀的涂抹至给药部位。之后,为了降低动物口部接触的风险,并最大程度模拟临床,通常会采用半封闭的透气材料覆盖,模拟临床衣物接触的情况。已有市售的动物T恤上市,比如下图中的Lomir T-shirt。
完成药物暴露后,先用温和的清洁剂(如Cetaphil)清洗,然后用自来水冲洗(至少两次),并用棉布吸干。
3、防止交叉污染
由于药物是外用给药,给药组小型猪如果摩擦围栏,有可能使阴性组动物被药物污染。因此,给药组和对照组动物要有足够的隔离空间,或分屋饲养。试验操作时尽量从空白组开始。技术人员在操作时要经常更换防护服和手套,并尽量避免接触给药表面。
4、给药持续时间
与其它类型药物类似,给药持续时间要覆盖临床给药周期,非啮齿类最长给药周期约9个月,如果是生物药物,最长6个月也是可以接受的。
5、检测指标
局外皮肤外用制剂需要采用打分系统考察药物对皮肤的作用。常用Draize系统评估皮肤刺激性。
其它指标评价如临床观察、体重、ECG、眼科检查、血生化、血常规、尿液分析等则与其它类型药物类似,不再赘述。
6、大体解剖和组织病理学检查
大体解剖时对皮肤应进行认真、仔细的检查,可以结合一般临床观察的结果一起评估。比如一般临床观察看到因血管充血导致的red discoloration会因解剖放血而消失,导致观察不到。除了对给药部位取材,未给药部位也应取材作为对照,未给药部位皮肤取材与给药部位的皮肤厚度和毛囊密度具有可比性。另外,不仅要考察对给药部位皮肤造成的局部毒性,还要考虑药物进入系统暴露后对其它部位皮肤的影响。通常对腹股沟部位的皮肤进行采集。
如果要做皮肤中药物浓度的TK检测,可以在皮肤固定之前,收集一部分完整厚度的皮肤。
组织病理学检查除按照常规要求对各脏器进行取材、镜检外,由于药物直接给到皮肤表面,通过皮肤吸收,需要对皮肤标本进行重点考察,包括毛囊、大汗腺、皮脂腺等。
案例分享
局部外用药OPZELURA的非临床研究内容
Ruxolitinib是一款小分子JAK1和JAK2抑制剂,2022年7月FDA批准上市,局部外用治疗白癜风及特应性皮炎。先看下这款产品的非临床研究开展了哪些试验?
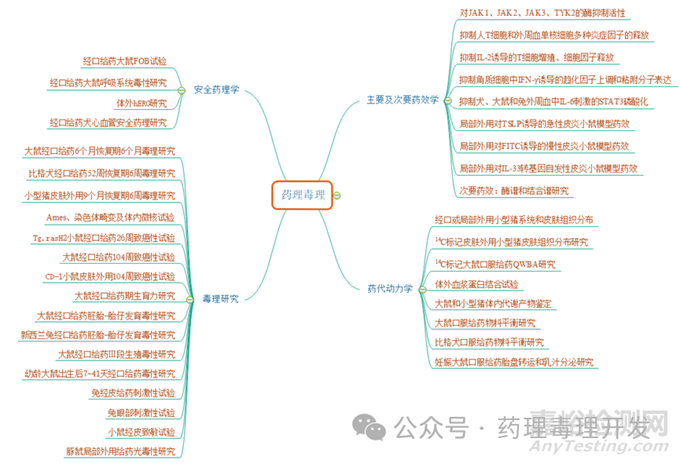
体外药效部分比较常规,开展的传统的体外酶活、细胞活性、信号通路等研究。体内则采用了3种不同的药效模型开展的研究,次要药效学主要考察的药物脱靶作用。安全药理部分也是传统的体外钾离子通道及体内三大系统研究。药代动力学除开展口服药物的ADME研究外,额外开展了小型猪的临床拟用途径的皮肤组织分布研究。
毒理部分开展的研究非常多,大致分为一般毒理、遗传毒理、致癌性、生殖毒和其它毒性。一般毒理采用的是两种属系统暴露给药、一个种属即小型猪的皮肤外用给药。遗传毒和生殖毒比较常规,不赘述。致癌性则是结合短周期转基因鼠+传统2年长周期组合的方案。由于临床拟用于12岁及以上人群,因此开展了幼龄动物的毒性研究。其它毒性主要涉及皮肤外用导致的刺激、过敏和光毒性风险。
最后
皮肤局部外用制剂的非临床研究之前有朋友私下讨论过,也有很多朋友对这个话题感兴趣,所以简单写了一期相关主题的文章。这类产品相较于传统系统给药制剂,最大的区别是在考量系统暴露的同时,需重点关注局部直接接触皮肤后引入的毒性风险,既包括一般毒性、也包括致癌性。除此以外,需要研究清楚局部外用后的PK变化,比较核心的是局部给药局部发挥作用的制剂,靶部位是皮肤,那么靶部位的药物暴露需要研究清楚,这点无论对于支持毒理学结果解释,还是临床剂量设计,都是有意义的。其它研究内容,如主要药效学研究、安全药理学研究、生殖毒性研究,可参考系统给药制剂。虽然指导皮肤局部外用制剂非临床研究的法规文件不多,但好在可参考的已上市药物还挺多,可以结合自己产品的特点,科学合理设计非临床研究策略。