一、背景
细胞治疗是利用来自患者或供体的活细胞来替代受损或患病的细胞或刺激身体的免疫反应或再生的治疗。根据细胞的种类来源分为干细胞治疗和免疫细胞治疗,免疫细胞主要是T细胞、NK等免疫细胞。干细胞治疗的监管与免疫细胞治疗的监管有所差异。本文将重点讨论免疫细胞的监管以及结合已上市CAR-T治疗产品,分析相关审评考量。
目前,我国对免疫细胞治疗产品分别按照医疗技术和药品同时监管,关于按照医疗技术目前的监管要求,2018年国家卫健委发布《医疗技术临床应用管理办法》,指出可在医疗机构开展临床研究,不可临床应用。
二、免疫细胞治疗产品的监管路径
2.1 作为医疗技术监管的发展沿革
关于医疗技术的临床应用管理,最先出台的是2009年3月由原卫生部引发的《医疗技术临床应用管理办法》,明确对医疗技术临床应用实行分类、分级管理,明确将医疗技术分为三类,对第二类、第三类医疗技术实施准入管理,三类医疗技术应用于临床由卫生部审核监管,二类省级卫生部门即可。
同年5月卫生部发布《首批允许临床应用的第三类医疗技术目录》,T细胞、NK细胞等细胞免疫治疗技术被列为第三类医疗技术目录。
由于免疫细胞临床应用的乱象,国家对免疫细胞治疗的临床应用进行收紧,2018年国家卫健委发布《医疗技术临床应用管理办法》,明确细胞治疗技术不作为临床应用管理。
2019年国家卫健委发布《体细胞治疗临床研究和转化应用管理办法(试行)》(征求意见稿),在卫健委的文件解读中,指出在临床研究取得体细胞治疗安全性、有效性等证据的基础上,总结形成针对某种疾病(适应证)的治疗方案和技术标准(包括细胞治疗的种类/途径、治疗剂量/次数和疗程等)。通过伦理审查,经备案后,可以在开展临床研究的医疗机构进入转化应用。
最终,由于业界担心医疗机构主导的临床应用缺乏药品监管路径的质量可控、标准统一等问题,因而最终并没有出台正式文件。
2.2 免疫细胞治疗产品依药品监管路径
药品监管路径需经IND、NDA申请批准上市,关于审评的技术指导原则,主要有4部。
2017年 <<细胞治疗产品研究与评价技术指导原则(试行)>>
2021年 <<免疫细胞治疗产品临床试验技术指导原则(试行)>>
2021年 <<基因修饰细胞治疗产品非临床研究技术指导原则(试行)>>
2022年 << 免疫细胞治疗产品药学研究与评价技术指导原则(试行)>>
由于免疫细胞治疗产品的特殊性,其研究评价区别于传统的小分子和大分子药物,需要有特殊的考量,尤其反应在非临床研究和临床研究评价中。
2.3 ITT路径
虽然监管禁止免疫细胞产品在医疗机构进行转化应用,但是却可以进行临床研究,即研究者发起的临床研究(ITT),目前对于ITT缺乏系统全面的监管细则,主要质量标准由开展ITT的医疗机构自行把握,整体水平参差不齐。另外CAR-T研发企业在进行IND之前会选择进行ITT研究,获得临床试验数据,有利于申报IND,这是CAR-T研发领域的一个特点。
因而现阶段关于免疫细胞治疗产品的监管已经明晰,可以总结如下:关于临床研究实行双轨制,可以走医疗技术路径开展临床研究,也可以走药品监管路径向NMPA申请IND开展临床试验,但是最终的临床应用需按照药品监管路径进行审评审批。
三、已上市CAR-T细胞治疗产品
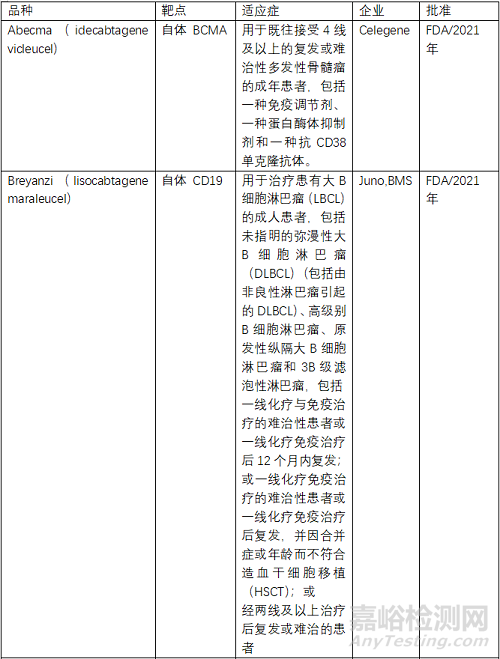
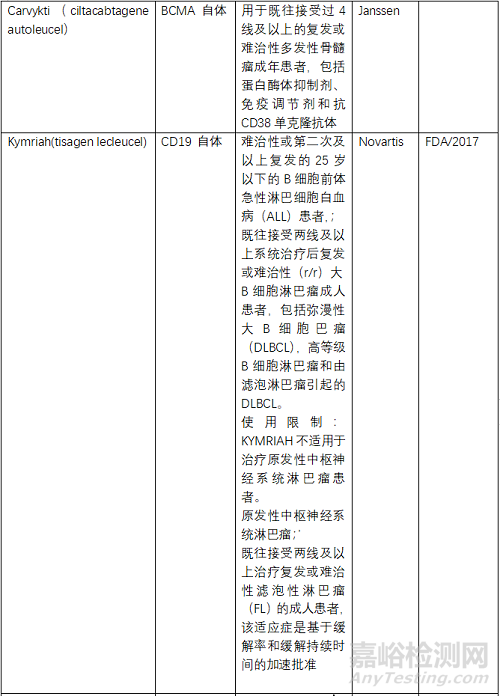
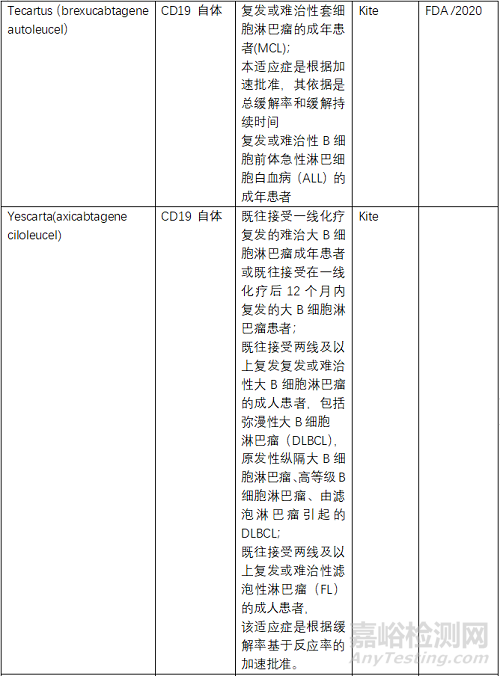
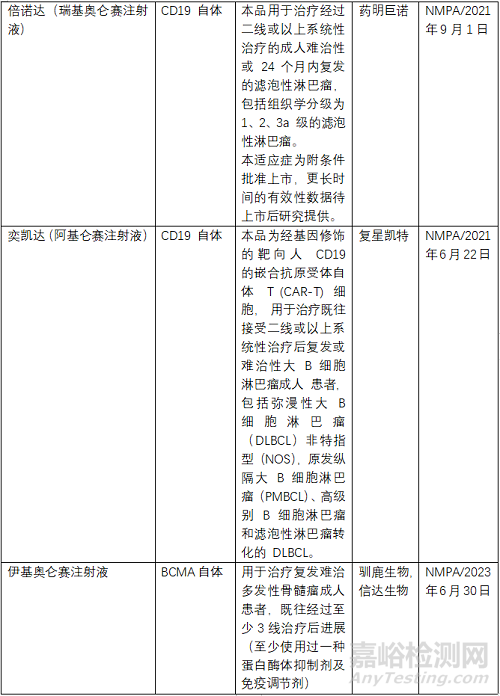
目前FDA共批准了6款CAR-T产品,2个靶点为BCMA、4个为CD19,均为自体CAR-T。NMPA批准了3款,其中复星凯特的产品来自美国Kite。驯鹿生物靶点为BCMA,其余2款靶点为CD19,均为自体CAR-T。
四、非临床研究审评考量
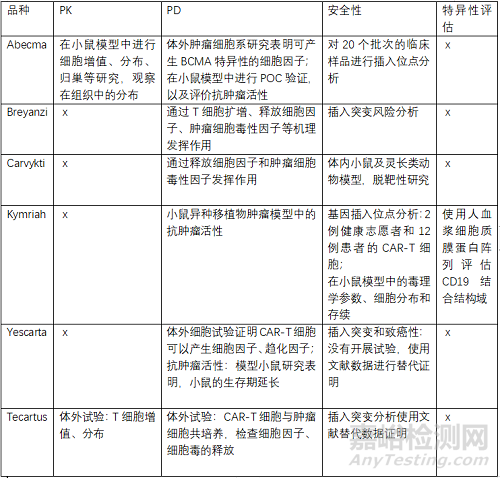
CAR-T细胞产品临床前主要评价PK、以细胞增殖、分布等指标,PD,以释放的细胞因子、趋化因子、抗肿瘤活性等指标,安全性重点评价插入突变分析等。
>>案例分析
五、临床研究审评考量
5.1 药效学(PD)评价
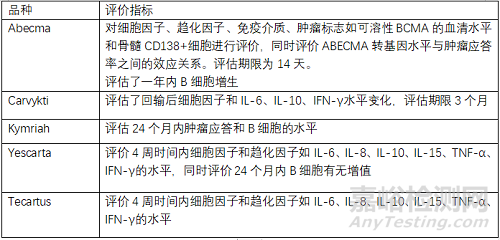
药效学评价:评价回输后细胞因子、趋化因子、免疫介质、肿瘤标志物(可溶性BCMA的血清水平和骨髓CD138+细胞)等水平变化,同时评价抗肿瘤活性,应答率等指标。
>>案例分析
5.2 药代动力学(PK)评价
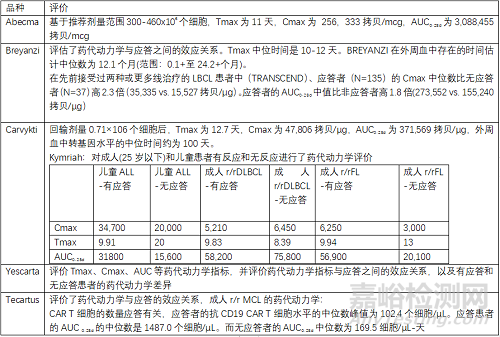
药代动力学评价考量为回输后CAR-T细胞的增殖、分化等变化,以Tmax Cmax AUC等表示。
>>案例分析
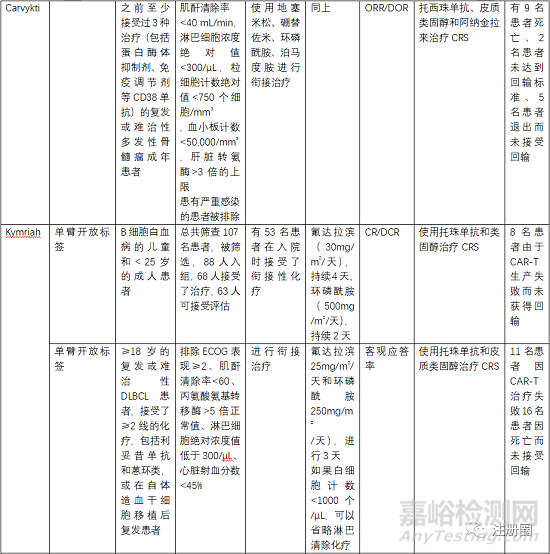
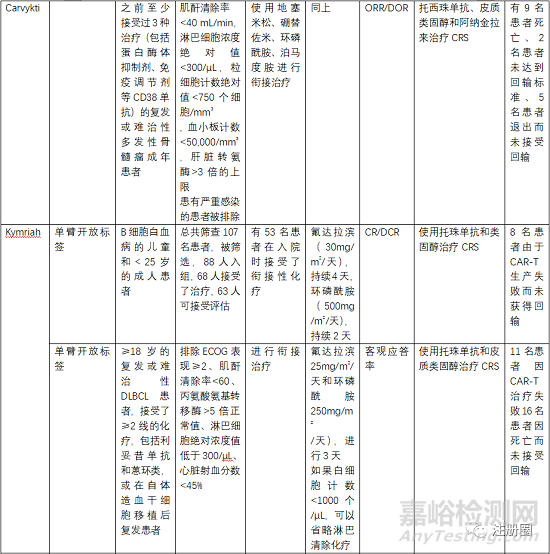
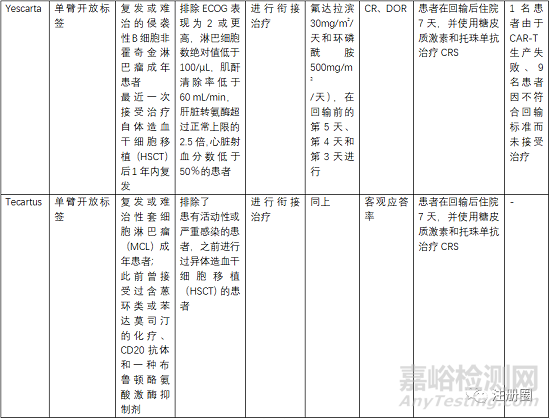
5.3 有效性与安全性评价
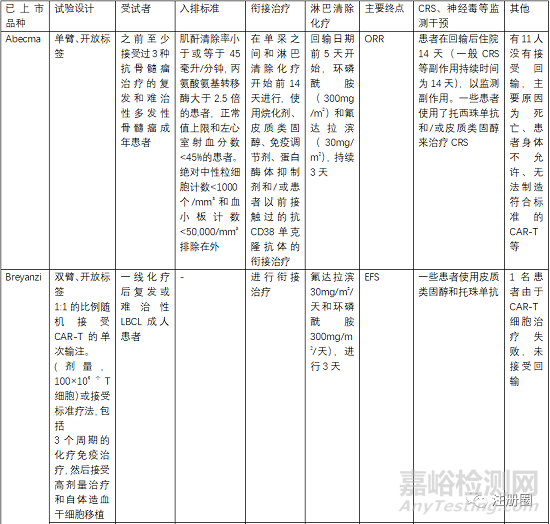
评估有效性和安全性的确证性临床关注点有受试者筛选、开放标签的单臂试验、以ORR(总缓解率)、客观应答率、EFS(无事件生存期)、CR(完全缓解率)等作为主要终点评价指。
受试者筛选的患者一般为3线或末线,这就决定了给药方案为单臂设计,另外对患者的入排标准进行严格控制,因为经过末线治疗的患者比较虚弱,很多条件达不到输注的标准。安全性一般重点关注CRS、神经毒性和严重感染,需要进行住院监测和手段干预。一般CRS等持续时间最多14天,所以临床试验中常安排监测7天或14天另外对于CRS等治疗常使用糖皮质激素和托珠单抗。在回输前需要衔接治疗和淋巴清除化疗。由于单采后CAR-T生产需要一定的时间,一般为10-20天生产时间,然后进行回输,回输时间为单采后的15-30天,所以,有的患者在此段时间内会发生死亡或者变得不符合回输治疗的标准。
>>案例分析