今日头条
创胜硬骨素单抗获批Ⅱ期临床。创胜集团靶向硬骨素的抗体新药TST002(blosozumab)获国家药监局批准开展Ⅱ期临床,评估单次及多次静脉滴注给药在骨密度降低患者的安全性、耐受性及药代动力学。TST002具有增强骨合成代谢和抗骨吸收的双重作用,可促进骨骼形成并抑制骨吸收,从而能快速提升骨骼密度和增加骨骼强度。在Ⅰ期临床中,ST002治疗使患者腰椎骨密度较基线平均增加3.52%~6.20%,均超过最小显著差异(2.77%)。
国内药讯
1.罗氏IL-6单抗启动中国眼科Ⅲ期临床。罗氏IL-6单抗RO7200220在中国登记启动一项国际多中心(含中国)Ⅲ期临床(Meerkat),拟评估用于玻璃体内给药,治疗葡萄膜炎性黄斑水肿(UME)患者的安全性和有效性。该研究的主要终点指标为第16周时平均最佳矫正视力(BCVA)相对基线改善≥15个字母的受试者比例,该项研究中国主要研究者由重庆医科大学附属第一医院杨培增医学博士担任。
2.泽璟CD3/DLL3三抗获批实体瘤临床。泽璟制药自主研发的三特异性抗体注射用ZG006(CD3 /DLL3/DLL3)获国家药监局临床试验默示许可,拟开发用于治疗晚期实体瘤。ZG006是全球首个针对DLL3表达肿瘤的三特异性抗体,该产品能衔接肿瘤细胞和T细胞,将T细胞拉近肿瘤细胞,从而利用T细胞特异性杀伤肿瘤细胞。此前,该新药已在美国获批临床,目标适应症为小细胞肺癌和其它实体瘤。
3.华东医药三靶点激动剂获批减重临床。华东医药旗下道尔生物1类生物药注射用DR10624获国家药监局批准临床,拟用于超重或肥胖人群的体重管理。DR10624是一款长效三靶点激动剂,同时靶向GLP-1R、GCGR和FGF21R,具有治疗糖尿病、肥胖症、非酒精性脂肪性肝病(NAFLD)、非酒精性脂肪性肝炎(NASH)等潜力。此前,DR10624已在新西兰获批开展Ⅰ期临床。
4.璎黎KRAS突变抑制剂国内获批临床。上海璎黎药业自主研发的泛KRAS突变小分子抑制剂YL-17231获国家药监局批准开展临床试验,用于晚期恶性实体瘤的治疗。在临床前研究中,YL-17231能够广泛抑制多种KRAS突变类型,适用于携带KRAS G12C、G12D、G12V、G13D、G12R、G12A等突变,以及KRAS野生型扩增的癌症和对KRAS G12C抑制剂(如sotorasib和adagrasib)产生耐药性的癌症。今年7月初,FDA已批准YL-17231在美国开展I期临床。
5.浸会大学便秘中药获FDA批准临床。香港浸会大学中药创新研发中心研发的用于治疗慢性便秘的中药复方新药获FDA临床许可,即将在美国开展Ⅰ期临床试验。这是一款按照FDA新药评审要求、并基于中药古方开发的中药复方,在治疗便秘的同时,还可以调节病人的体质。中药治疗便秘历史悠久,此次香港中药新药获批美国临床,为中药新药走向国际积累经验。
6.荣昌首款双抗获批实体瘤临床。荣昌生物自研新型双特异性抗体RC148获国家药监局临床许可,预期用于局部晚期不可切除或转移性实体瘤患者(包括不限于非小细胞肺癌、三阴乳腺癌、卵巢癌、宫颈癌、结直肠癌等其他可能获益的癌种)。这是一项I期临床,旨在评估RC148的安全性、耐受性、药代动力学(PK)、药效动力学、免疫原性、Ⅱ期推荐剂量以及初步的抗肿瘤疗效。
国际药讯
1.膀胱癌创新疗法两项Ⅲ期临床积极。UroGen公司膀胱灌注溶液UGN-102(丝裂霉素)治疗低分级、中危非肌层浸润性膀胱癌(LG-IR-NMIBC)患者的两项Ⅲ期临床(ATLAS和ENVISION)达到主要终点。在ENVISION试验中,UGN-102治疗3个月时达到79.2%的完全缓解率。在ATLAS试验中,UGN-102使患者复发、疾病进展或死亡的风险降低55%。该公司预计在2024年递交新药申请(NDA)。如果获批,UGN-102将是首个治疗膀胱癌患者亚群的非手术治疗药物。
2.默沙东21价PCV两项Ⅲ期临床积极。默沙东21价肺炎球菌结合疫苗V116用于未接种过肺炎球菌疫苗(STRIDE-3试验)和接种过疫苗(STRIDE-6试验)的两项III期研究结果积极。在STRIDE-3试验中,初次接种后30天的血清型特异性嗜溶性蛋白细胞活性 (OPA) 评估显示,与辉瑞Prevnar 20相比,V116对于两种疫苗中共有常见的血清型产生显著的免疫反应。对于V116特有的血清型,也观察到阳性免疫反应。在STRIDE-6试验中,V116对所有21种肺炎球菌血清型都具有免疫原性。V116的安全性与对照药物相当。
3.渤健73亿收购罕见病药物公司Reata。渤健将以交易总额约为73亿美元收购Reata公司,预计2023年第四季度完成。Reata公司开发的Nrf2激动剂Skyclarys(Omaveloxolone)已于今年3月获得FDA批准上市,是首款针对弗里德赖希共济失调症(FA)患者的治疗药物。Omaveloxolone靶向Nrf2转录因子并诱导多个分子通路以恢复线粒体功能、降低氧化应激、抑制促炎信号,以减轻炎症反应。预测到2030年,该产品销售值有望达到15亿美元。
4.武田EGFR Exon20抑制剂肺癌III期临床失败。武田在2023财年Q1季报中透露,口服EGFR Exon20抑制剂Exkivity (Mobocertinib) 一线治疗EGFR外显子20(Exon20)插入突变的非小细胞肺癌(NSCLC)的III期EXCLAIM-2试验因无效而终止。2021年9月,基于一项Ⅰ/Ⅱ期临床中mobocertinib达到28%的确认客观缓解率的积极数据,FDA加速批准Mobocertinib上市,成为首款用于这类NSCLC患者的口服疗法。今年1月,该新药也获批中国上市。
5.辉瑞任命新的首席肿瘤学研发官。辉瑞宣布Chris Boshoff医学博士将加入辉瑞高管团队,担任首席肿瘤学研发官和执行副总裁,向董事长兼首席执行官Albert Bourla汇报。Boshoff博士将成为整个肿瘤产品管线从发现到早期和后期临床开发唯一负责人。此前,Boshoff博士负责监管辉瑞肿瘤学产品组合的临床研究和产品开发活动,包括涉及30多项适应症的24款创新抗肿瘤新药和生物类似药,以及辉瑞行业领先的跨越四个治疗领域的罕见病创新药物组合。
6.艾伯维2023H1发布。7月27日,艾伯维公布2023H1财报,上半年总营收260.9亿美元,同比下降7.2%;研发投入40.25亿美元,同比增长29.6%,占总营收的15.4%。自免领域仍是艾伯维业绩的主要来源,上半年收入124亿美元(-7.1%),其中Humira(阿达木单抗)75.53亿美元(-25.2%),Skyrizi(瑞莎珠单抗)和口服JAK1(乌帕替尼)分别收入32.43亿美元(+48%)和16.04亿美元(+51.7%)。
医药热点
1.海南医学院将更名海南医科大学。近日,海南医学院官网公布《海南医学院更名事项社会稳定风险评估公示》,海南医学院经认真研究和反复论证,认为已具备更名“医科大学”的基本条件,计划更名为海南医科大学。此前,为了配合更名医科大学,海南省委、省政府给海南医学院在江东新区批了787亩地,前期的总规科研概算均已经批复,2022年年底进行奠基,预计两年半能够建成。
2.我国完成全球首例泌尿外科超远程机器人手术。近日, 北京大学第一医院泌尿外科与海南省中医院两地的医护团队同步操作,相隔3000公里完成跨海超远程机器人手术,创造了全球首例的记录。这是一台机器人辅助前列腺癌根治术, 是国产手术机器人研发应用的又一里程碑事件。手术第一次实现跨海超远程(>1500公里)实时无延迟通信,系统控制由双控制台实现,新增的“批注”功能增强了手术团队交互能力,通过权威专家教学指导,提升了海南医疗团队完成复杂疑难手术的诊疗能力。
3.CDE发布办公地址搬迁有关通知。7月31日,国家药监局药审中心宣布,药审中心将搬迁至新址办公,搬迁时间为2023年8月3日—8月9日,此期间暂停对外办公,8月10日上午8:30恢复对外办公。搬迁后办公地址及联系方式地址:北京市经济技术开发区广德大街22号院二区1—5号楼,邮编:100076,联系电话:010-68585566。自2023年8月10日起,药审中心启用新办公地址接收公函类文件及注册申请资料邮包。
评审动态
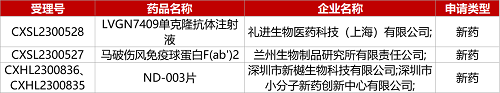
1. CDE新药受理情况(07月31日)
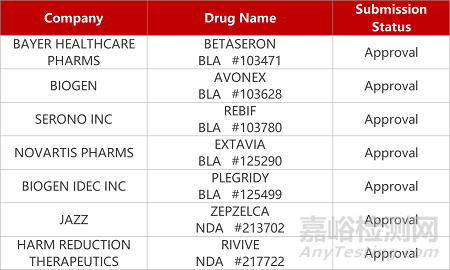
2. FDA新药获批情况(北美07月28日)