《中华人民共和国人类遗传资源管理条例》规定,利用我国人类遗传资源开展国际合作科学研究,应由国务院科学技术行政部门批准。由于递交相关申请时需要提供准确的样本与数据采集量,因此需要进行准确的数据计算,并对筛选失败率、访视数量和样本采集量等数据进行合理估算。如果涉及重要变更,如方案、参与方变更,或样本采集即将超过批准范围时的样本采集量变更等,需要及时获知相关情况并提交变更申请;研究进行过程中,需要及时按照相关法规对数据进行备份备案。该流程发生风险的可能性中等,但对于在我国进行的临床试验,其中的人类遗传资源样本、数据一旦在不符合要求的情况下出境,流失到外国,会产生潜在的生物威胁,并影响受试者的隐私和数据安全,因此影响的严重程度高。
此流程的风险防范措施,包括在就人类遗传信息相关事务进行初次申请时,应对项目和中心的实际情况有全面且充分的了解,并依此确定合理的数据和样本量。在项目进行的过程中,申办方及CRO 公司应设置明确的责任人,如项目经理或注册事务部人员等,定期对人类遗传办公室相关问题,如批件是否即将超期,采集数量是否超过批件限制等进行自查。
2、研究中心监查访视和关闭访视
研究中心监查访视通常是周期性发生的现场监查活动,目的是对临床试验的进展进行监督。进行监查访视时,监查员需要在有限的时间内完成多项访视活动,对研究中心试验进展情况进行了解、评估并对相关方进行沟通与协调。访视活动的流程具有一定的复杂性,如在进行原始数据核实与检查、研究器械的清点等步骤时,都需要交叉核对大量文件。监查访视结束后,会产生待解决问题和相关文件,存在问题被搁置、遗忘、解决不充分,及文件发送、归档不及时的风险。中心关闭访视通常为项目的最后一次监查访视,此时需要确保此前中心出现的问题已全部得到解决,研究中心已经处于随时可以进行核查的状态,并明确研究者后续职责,因此存在问题未得到充分解决等风险。
综上,该流程风险发生的可能性高,影响的严重程度为中等。 通过分析此过程问题发生的根本原因和流程中的薄弱环节,我们得出的风险防范措施可包括以下几个方面:①人员方面。项目经理关注监查员经验,对经验不足的监查员及时进行培训和提供必要的帮助。②监查访视方面。项目经理关注访视报告中的问题,对于长时间(如 90 d 以上)仍未解决的困难问题,应协助临床监查员进行解决。③研究中心管理方面。TIMMERMANS 等曾提出使用统计学方法,通过监测研究中心产生的明显偏离于平均值的数据,从而识别中心风险并进行管理。根据此思路,对于出现入组较多、较快,严重不良事件报告数量过少,长时间未安排会见研究者等风险信号的研究中心,项目经理可以及时安排质量管理人员或项目经理与监查员共同访视。④时间安排方面。项目经理确认访视按照监查计划规定的时间按时进行,对于高风险中心可适当提高监查频率。
3、TMF的管理
TMF 是需要保存的临床试验的过程性文件。由于临床试验中的文件记录具有重现临床试验过程的意义,因此至关重要,这也使得 TMF 成为稽查与核查中关注的重点。由于临床试验的每个步骤都需要详细、准确地被记录,TMF 具有文件数量大,分类繁杂,涉及相关方多的特点,有可能出现文件收集不完全、质量不合格、回收时间过长等问题。该流程风险发生的可能性高。
该流程的风险防范措施,包括:项目经理及时建立负责项目的必备文件清单,供临床监查员和临床试验助理遵循使用,以防文件缺失;明确每个文件的责任人,建立相关问责机制;设置回收的关键时间节点,督促责任人及时回收相关文件;建立完整可靠的质量检查流程,如设置专门的人员进行 TMF的质量检查工作。
4、项目管理
项目管理人员需要提前结合标准操作规程(standard operation procedure, SOP),制定完善的项目管理计划和监查计划等,并监督项目组成员严格执行;对于项目信息和项目文件(如方案、研究者手册和知情同意书等)的更新,需要及时与相关方进行充分、及时、有效地沟通;对于项目使用的系统,需要确保其有效运行并持续被维护;制定清晰、准确的财务管理流程;提前制定风险管理计划,并且针对项目进程中出现的问题,建立畅通有效的上报流程和制定有效的纠正预防措施;选择供应商时,严格执行资质审核,必要时为其提供特定培训,确保其符合方案和公司 SOP 要求;与研究中心和申办者签订合同前应有审核步骤,尤其是涉及相关服务范围更新时,应对合同进行完整重审;在项目组成员进入项目前和项目信息有更新时应及时对其进行培训。
5、伦理委员会递交与审查
进行中心选择访视时,提前了解研究中心伦理委员会召开伦理评审会议的频率和审查流程,选择符合项目要求的中心;初次递交时,将递交的文件与临床试验批件、人类遗传资源办公室批件、合同等文件进行交叉核对,确保文件信息正确;对于伦理委员会提出的问题,CRO 公司应与申办方沟通,及时回复并作出相应改进措施;由于伦理委员会审查是一个持续的过程,还需要及时设置时间点提醒,在相关文件更新后或年度 / 其他周期性审查截止时间点前,及时将相关材料递交给伦理委员会审查。
6、数据管理
数据管理部门制定完善的数据管理计划和各流程检查表;设置用户权限控制清单,通过交叉核对,以保证正确的用户拥有正确的权限;根据实际操作流程、法规及合同要求,对数据录入系统的使用人员进行相关培训;为病例报告表设置准确的逻辑核查规则;数据管理人员确认数据录入人员回复数据质疑,并检查无误后,方可关闭质疑;对于来自第三方和 / 或由第三方进行处理的外部数据,需要制定并执行质量检查流程;数据库锁定后如仍需解锁,需提供充足的理由并分析解锁造成的影响。
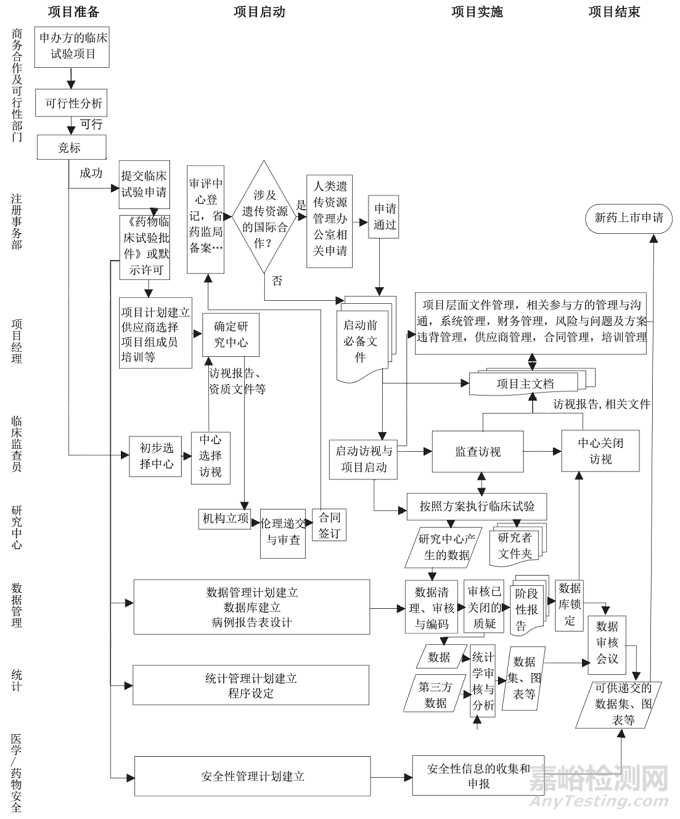
7、CRO运营临床试验全流程
CRO最显著的特点是将临床试验专业化和高效率化。作为申办方的一种可借用的外部资源,可以帮助企业提高新产品上市的速度,降低企业的管理和研发费用投入。以下是CRO运营临床试验全过程的流程图,希望可以帮助到大家图片