今日头条
阿斯利康哮喘复方获FDA批准上市。阿斯利康与Avillion联合开发的加压定量吸入疗法Airsupra(沙丁胺醇/布地奈德)获FDA批准上市,用于治疗18岁以上成人,以避免患者支气管收缩并降低其哮喘恶化风险。在Ⅲ期临床MANDALA中,与沙丁胺醇抢救相比,沙丁胺醇/布地奈德(180/160mcg)使疾病严重恶化的风险显著降低27%(p<0.001),使平均年化系统性皮质类固醇暴露总量减少33%(p=0.002)。
国内药讯
1.武田EGFR-TKI新药在华获批。武田EGFR-TKI靶向药物琥珀酸莫博赛替尼胶囊(mobocertinib)获国家药监局附条件批准上市,用于含铂化疗期间或之后进展且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌成人患者。在Ⅰ/Ⅱ期临床中,mobocertinib达到28%的确认客观缓解率,中位缓解持续时间为17.5个月,中位总生存期为24个月,中位无进展生存期为7.3个月。
2.辉诺抗流感病毒新药获批临床。辉诺医药流感病毒聚合酶抑制剂1类化药HN0190获国家药监局临床试验默示许可,拟用于甲型和乙型流感病毒感染的治疗与预防。HN0190通过阻止病毒聚合酶功能及病毒mRNA转录,抑制流感病毒复制。临床前研究显示,HN0190对甲型、乙型野生型流感病毒和现有抗流感病毒药物耐药株均有良好的抑制活性,且安全性良好。
3.启辰生mRNA-DC疫苗获批肿瘤临床。启辰生生物研发的1类生物制品靶向Survivin DC细胞注射液获国家药监局临床试验默示许可。这是一款mRNA-DC疫苗,将抗原mRNA负载的树突状细胞(DC),分别通过皮内注射和静脉回输的方式给予患者,诱导抗原特异的CD4+和CD8+T淋巴细胞,为原发性脑胶质母细胞瘤患者术后清除肿瘤残余细胞,防止复发,延长生存期,实现长期抗肿瘤效果提供全新的治疗手段。
4.泰诺麦博NGF单抗国内报IND。泰诺麦博1类生物制品TNM009注射液的临床试验申请获CDE受理,拟开发用于骨关节炎疼痛的治疗。TNM009是一款特异性靶向NGF的单抗药物,通过中和体内的NGF以阻断NGF/TrkA信号通路,缓解疼痛。在临床前研究中,TNM009在多个动物模型中均显示出积极的疼痛缓解能力,并具有良好的安全性。
5.以岭CLDN18.2单抗国内报IND。以岭药业自主研发的1类生物制品BIO-008的临床试验申请获CDE受理,拟用于晚期实体瘤的治疗。BIO-008是一款靶向Claudin18.2的单抗药物,通过抗体和补体依赖介导的细胞毒性作用,诱导细胞凋亡、抑制肿瘤细胞增殖,杀伤Claudin18.2阳性肿瘤细胞。目前,全球Claudin18.2靶向药临床进度最快的是安斯泰来的zolbetuximab(IMAB362),处于Ⅲ期临床阶段。
6.康泰新冠疫苗销量同比大幅下滑。康泰生物1月10日公告,预计2022年亏损7600万元-1.5亿元,上年同期净利润12.6亿元。报告期内由于国内外新冠疫苗接种环境发生重大变化,公司新冠疫苗销量较去年大幅下滑,公司对2022年度存在减值迹象的新冠疫苗相关库存商品、原辅料、自制半成品、生产设备及新冠灭活疫苗开发支出计提资产减值准备7.85亿元,新冠灭活疫苗Ⅲ期临床研发支出费用化处理3亿元。
国际药讯
1.FIC银屑病新药向EMA报产。Can-Fite公司潜在“first-in-class”A3AR激动剂piclidenoson已向欧洲药品管理局(EMA)提交上市申请,用于治疗中重度斑块状银屑病。piclidenoson旨在通过抑制炎症细胞因子白细胞介素17和23的表达以及诱导致病性皮肤细胞角化细胞的凋亡达到治疗效果。在Ⅲ期临床COMFORT中,piclidenoson较安慰剂使患者在16周时达到PASI75应答的患者比例更高(9.7%vs2.6%,P<0.04)。康哲药业拥有piclidenoson的中国权益。
2.抗精神病药物治疗AD激越获优先审评。Otsuka公司与灵北联合开发的非典型抗精神病药物brexpiprazole的补充新药申请获FDA纳入优先审评,用于治疗阿尔茨海默病型痴呆相关激越症状,PDUFA日期为2023年5月10日。在Ⅲ期临床中,与安慰剂组相比,brexpiprazole治疗组12周后评估激越症状的CMAI评分的改善具有统计学显著性(p=0.0026);评估患者疾病严重程度的CGI-S评分也具有显著改善(p=0.0055)。
3.辉瑞20价肺炎球菌疫苗获优先审评资格。辉瑞20价肺炎球菌疫苗(20vPnC)的补充生物制品许可申请(sBLA)获FDA授以优先审评资格,用于预防6周到17周的婴儿及儿童感染侵袭性肺炎球菌病及相关的中耳炎。PDUFA日期为2023年4月。在Ⅲ期临床中,与活性对照(Prevenar 13)相比,3剂20vPnC接种后一个月,受试者的IgG的平均几何浓度(GMC)在19个血清型中达到非劣效性标准。所有20个血清型表现出强有力的功能性抗体反应。
4.艾伯维5.4亿美元布局“不可成药”靶点新药。艾伯维与Anima Biotech将利用后者专有的mRNA平台,针对艾伯维指定靶点,合作开发至多3个mRNA调节物候选药物。Anima专有mRNA创新平台能够协助发现靶向mRNA生物学的小分子药物以及其相关机制。目前,Anima已拥有包含靶向1型胶原蛋白治疗纤维化、靶向c-Myc与突变Kras治疗癌症、靶向Tau蛋白等mRNA生物调节物。根据协议,Anima将获得4200万美元的预付款,最多5.4亿美元的研发、商业化里程碑潜在付款。
5.Moderna公司2022年新冠疫苗销售达184亿美元。Moderna公司宣布2022年公司疫苗销售额为184亿美元。2021年,Moderna新冠mRNA疫苗mRNA1273的销售额为176.75亿美元。Moderna公司首席执行官Stéphane Bancel还在今年摩根大通医疗保健大会上透露,已通过确认的预购协议和2022年延期合同,确定2023年至少有50亿美元的Covid-19疫苗销售。Bancel表示,公司正在考虑在美国将疫苗的价格定在每剂110美元至130美元。
医药热点
1.黄华波任国家医保局副局长。人社部1月10日发布国务院人员任免公告,任命黄华波为国家医疗保障局副局长。公开资料显示,黄华波,男,汉族,1970年1月生,湖北孝感人,在职研究生学历,经济学博士,曾任人力资源和社会保障部社会保险事业管理中心副主任。2018年5月起任国家医保局监管组牵头人,2018年11月任国家医保局基金监管司司长。此次履新前,黄华波担任国家医保局医药服务管理司司长。
2.紧急医学救援“十四五”规划发布。近日,国家卫健委印发《突发事件紧急医学救援“十四五”规划》。《规划》指出,要在全国布局20支左右重大疫情医疗应急队伍,满足国家和区域重大疫情医疗救治需要;各市(州)、县(市、区)要以市(州)、县(市、区)医疗机构为依托,在各县级行政区建设一支基层背囊化医疗应急小分队。
3.XBB.1.5变异株或造成感染率增加。针对近期在欧美受到关注的奥密克戎变异株亚谱系XBB.1.5,世卫组织11日发布首份风险评估。从2022年10月22日至今,世卫共收到来自38个国家和地区报告的5288份XBB.1.5病毒基因测序,其中有82.2%来自美国。评估显示,根据XBB.1.5的遗传特征以及对其早期传播增长速度的估计,这种亚谱系可能会造成感染率的增加。世卫还表示,对XBB.1.5致病严重程度的评估仍在进行中,当前还未发现该亚谱系带有已知的可能改变致病严重程度的突变。
评审动态
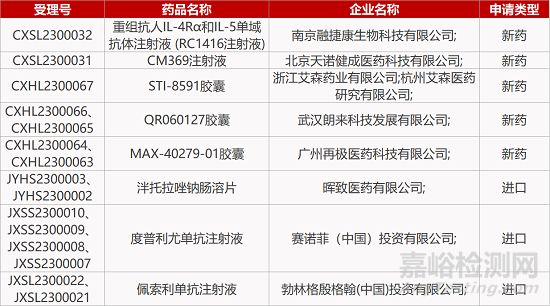
1. CDE新药受理情况(01月12日)
2. FDA新药获批情况(北美01月10日)