您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-29 09:03
设计开发转换是产品实现中的重要环节之一,其目的在于将设计好的产品正确地转换为产品的生产规格,以便生产制造出满足需求的产品。
01、QSR820对设计开发转换的要求
820.30 (h) Design transfer.Each manufacturer shall establish andmaintain procedures to ensure that the device design is correctly translatedinto production specifications.
设计开发转换。制造商应建立和保持程序,确保器械设计正确的转化为生产规范。
浅析:FDA的要求就是把Device design正确地转换成产品规格。
02、ISO13485对设计开发转换的要求
7.3.8 Design and development transfer 设计和开发转换
The organization shall document procedures for transfer of design and development outputs to manufacturing.
组织应建立设计开发输出转换为生产制造的程序。
These procedures shall ensure that design and developmentoutputs are verified as suitable for manufacturing before becoming final productionspecifications and that production capability can meet product requirements.
设计和开发转换程序应该确保设计和开发输出在成为最终生产规范前经验证适合于制造,并确保生产能力能满足产品要求。
浅析:ISO13485明确需要将设计开发输出转换为生产制造,并要求设计和开发输出在成为最终生产规范前经验证且适合于制造,并确保生产能力能满足产品要求。
03、医疗器械生产质量管理规范对设计开发转换的要求
第三十二条 企业应当在设计和开发过程中开展设计和开发到生产的转换活动,以使设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
浅析:医疗器械生产质量管理规范对设计开发转换的要求,更靠近ISO13485关于设计开发转换的要求。强调在设计和开发过程中开展设计和开发到生产的转换活动,以使设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
04、设计开发转换的过程浅析
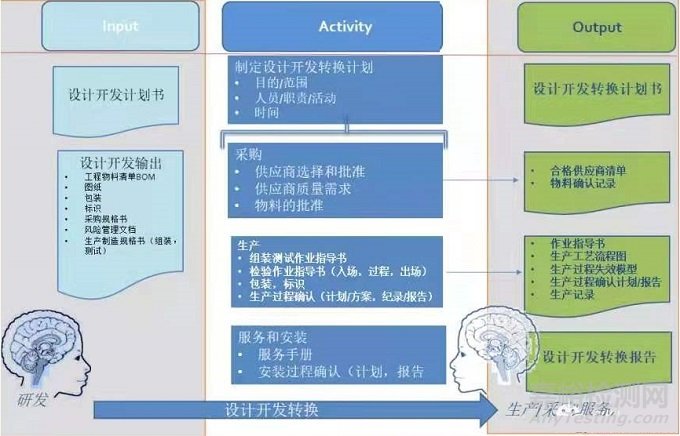
首先是设计控制中的第一个元素“设计开发策划”。
在设计开发策划文件中,需要将设计开发转换活动进行策划,也可以单独建立设计开发转换计划来明确设计开发转换活动的起始时间、活动、需要的输入、需要的输出以及在过程中的相关主体及其职责的分配。
接着,就是明确“设计开发输出”的范围。
一般来说设计开发输出包括设计开发输出包括采购、生产和服务所需的相关信息、产品技术要求、图纸、采购规格、包装、标签、说明书等。完成设计开发转换就是将研发所产生的输出转换用于采购、生产、服务使其能够买到正确的原材料,生产制造出正确的产品,安装出满足需求的产品。
所以,设计开发转换活动从选择供应商,决定哪些需要购买哪些原材料开始,完成于生产过程确认,安装过程确认后。采购控制,生产过程控制,服务控制几个质量模块适用于此过程中。
也就是说,使设计和开发的输出在成为最终产品规范前得以验证,并不只是单纯的设计开发验证,而是包括采购产品的验证及生产过程的验证和确认。

来源:Internet


