您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-15 20:58
为证明所采用的分析方法是否适合于相应检测要求和目的,被测样品质量是否可控,保证得到一致、可靠和准确的测定结果,检测人员是否有能力操作分析方法,进行化学药品分析方法的验证、转移和确认。
方法验证(method validation)
[概念]
实验室通过试验设计和测试,对方法学参数进行全面的验证,以证明方法适用于拟定检验用途。
[核心]
由方法建立者进行,即谁建立方法谁负责验证,方法建立者必须要证明所建立的方法能满足期望的检测用途。
[方法学验证参数]
由方法建立者进行,即谁建立方法谁负责验证,方法建立者必须要证明所建立的方法能满足期望的检测用途。
表1、不同国际组织和
药典要求的方法学验证参数
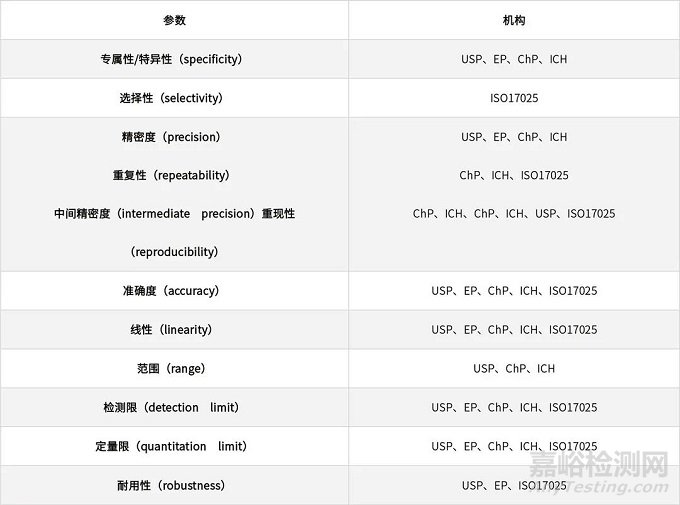
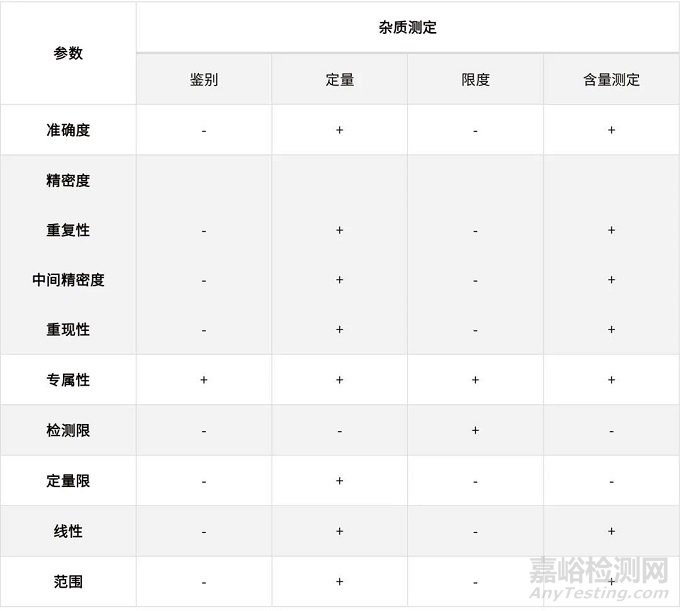
表2、ICH指导原则中规定的
不同检验目的需要验证的参数
[概念]
一个实验室建立好分析方法并经过验证后,当其他实验室(方法接收实验室)在使用这个方法进行检验检测时,这就牵涉到方法在两个不同实验室之间的转移问题,接收方法的实验室需要证明其能够成功的在本实验室中运行该方法。
[分类]
✦通过比对检验进行方法转移:1批或多批次样品检测结果;
✦通过共同验证进行方法转移:分析方法的验证和转移合并一起同时验证;
✦通过再验证进行方法转移:接收实验室重复部分或所有的方法学验证试验;
✦由于X公司购买了Y公司的的产品,方法由Y公司转移到X公司。
[转移类型]
✦由公司的研发实验室转移到质控实验室;
✦生产线转移使分析方法由A生产地点转移到B生产地点;
✦由CRO公司转移到合同公司;
✦通过免除试验进行方法转移:不预先进行检验结果比对而直接进行正式检验(一定要有记录并说明原因)。
[转移流程]
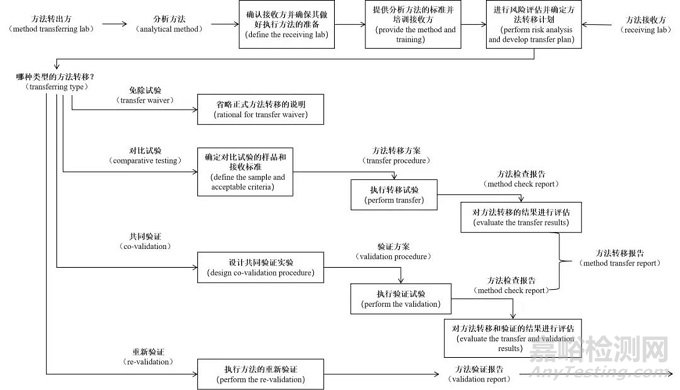
▲图1、分析方法转移流程图
[接收标准和结果评价]
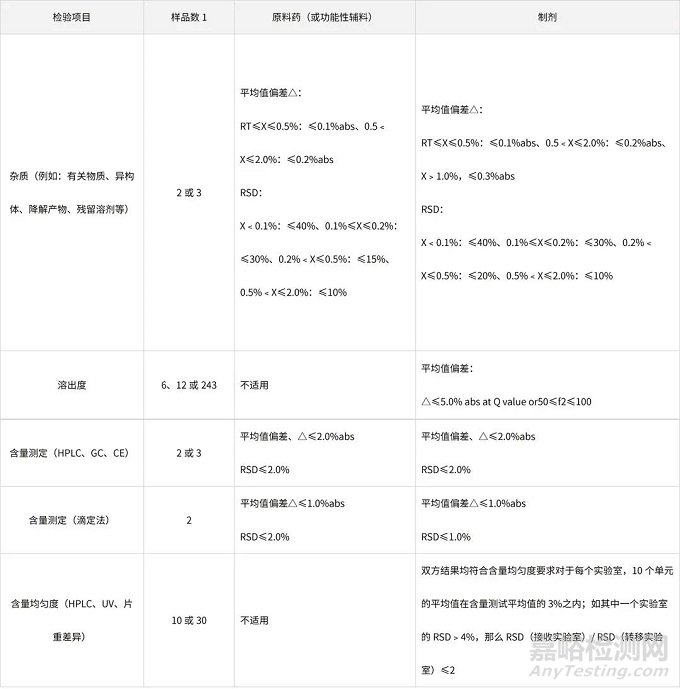
表3、通过比对试验进行某样品(原料或
制剂)相关分析方法转移的接收标准事例
备注:
(1)△:转出实验室和接收实验室的平均值绝对偏差;
(2)RT:报告阈值(report threshold value);
(3)2:中间精密度,如n=4,则是在转移实验室和接收实验室进行的2个重复测定的相对标准偏差;
(4)3:根据USP、EP和JP制定;
(5)上表列举的接收标准会因样品规格、生产工艺、分析方法以及产品的质量标准而变化。
[转移报告]
方法转移报告由接收实验室的检测人员汇总转出实验室和接收实验室的检测结果,并根据方法转移方案中的接收标准对整个方法转移做出评估和总结。如分析方法需要进行任何变更,转出实验室应在方法转移总结报告中提出分析方法变更的细节和评估变更后的方法是否需要验证。如果是共同验证或再验证,接收实验室的结果由转出实验室的检测人员根据最后阶段验证报告进行核对。共同验证的结果须放在方法转移报告中,保证可追溯性。
如果接收实验室需要使用不同的供试品溶液制备方法,如使用自动样品制备系统代替手动样品制备,方法转移中需要说明这个变化仍能适用于实验目的的理由,变化产生的相关结果和结论需要在方法转移报告中详细记录。
转出实验室和所有参与的接收实验室都要审核方法转移报告并由所有相关实验室的审核部门批准。
转移报告可能包括以下内容:被测样品名称;转移的分析方法(名称、版本);方法转移方案;接收实验室人员的培训记录;责任(如方法转移报告的审核和批准);转移中使用的仪器、器具和试剂;转出实验室和接收实验室的检测结果;评估方法转移报告中的偏差及异常结果的调查;根据接收标准评估数据;后续的工作安排(如果适用);总结和结论。
方法确认(method verification)
[概念]
根据方法的用途和方法的复杂程度,选择性地选择对检测结果影响最大的关键方法学参数进行考察。
[核心]
✦必须是对药典分析方法或法定分析方法进行确认;
✦证明药典分析方法或法定分析方法适用于被测样品,被测样品的质量可控,方法可行;
✦证明方法使用人员有能力成功的操作药典分析方法或者法定分析方法。
[具体内容和流程]
一般来说,如果没有特别说明不适用测定某个样品,药典中所收载的基本检验方法不要求进行方法确认。这些基本检验方法包括:干燥失重、炽灼残渣、重金属、热分析法等,以及各种湿法化学分析(比如酸值测定)和用简单的仪器进行检验(如pH测定)等。
参考欧洲OMCL的《分析方法验证》、AOAC的《如何达到ISO 17025对方法确认的要求》以及《美国药典》附录1206,并结合我国药品检验实际工作内容,把常规药品检验方法按照被测化合物的浓度高低分为3类,列出了方法确认内容具体要求,以期为广大药品监管和检验工作者提供一个具体的参考。
✦鉴别检查:目的在于判断被测物是否是目标检测物。
表4、鉴别检查
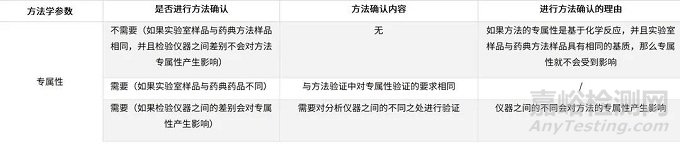
✦被测物浓度在定量限附近的限度检查(残留溶剂/有关物质/致突变杂质等)
表5、在定量限附近的限度检查
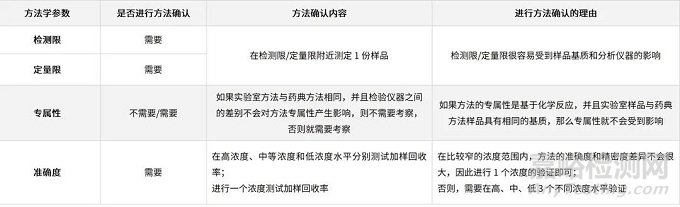
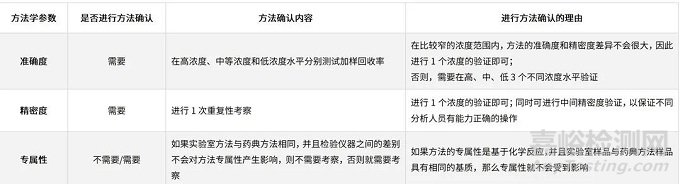
✦较高浓度的限度检查和含量测定(含量/含量均匀度/溶出度等)
表6、在较高浓度的限度检查和含量测定
✦其他:实验室和方法确认的有关文件应该包括:①确认计划;②被确认方法的详细描述;③需要进行确认的方法学参数的详细描述;④确认结果的判断标准;⑤对偏差的合理解释。
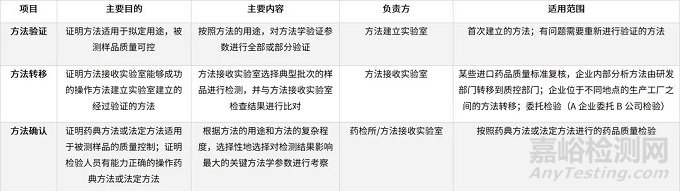
联系与区别
表7、方法验证、方法
转移和方法确认的联系与区别
参考文献
【1】2019年版中国药品检验标准操作规范
【2】2020年版中国药典
【3】ISO17025
【4】ICHQ2分析方法的验证

来源:Internet


