您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-11 13:24
摘要:本文结合《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求( 试行) 》等相关技术要求,概括并拟定了口服固体仿制药体外一致性评价的决策树,论述了不同情况下体外评价考察项目的差异和常见问题,重点分析了非常规研究项目的技术要求和关注问题,并提出相应的处理建议,旨在为后续口服固体仿制药一致性评价的研究提供更多的参考。
口服固体制剂一致性评价工作自2017 年正式开展以来取得了显著进展,申报品种的整体研究水平有明显提高,主要表现在体外评价研究日趋完善,发补问题逐渐减少、通过一致性评价率不断提高。作为新颁布的《药品注册管理办法》[1]的配套文件,《化学药品注册分类及申报资料要求(征求意见稿)》[2]再次明确要求3 类、4 类和5.2 类仿制药应与参比制剂的质量和疗效一致。一致性评价工作早已不是阶段性的工作,而是作为仿制药上市的基本要求,贯穿于上市申请的始终,相关要求也更加细化。本文结合《关于发布化学药品仿制药质量和疗效一致性评价申报资料要求(试行)的通告》(2016 年第120 号) [3]、《关于仿制药质量和疗效一致性评价有关事项的公告》( 2017 年第 100 号) [4]及相关要求,绘制了口服固体仿制药体外一致性评价的决策树(图1),以此为基础,通过代表性的案例,重点分析了非常规研究项目的技术要求和关注问题,并提出相应的处理建议,同时讨论了申请生物等效性(bioequivalent,BE)豁免品种和无法推荐参比制剂品种等特殊情况下体外评价研究的侧重点和常见问题,旨在为后续口服固体仿制药的申报提供更多的参考[药研公众号整理排版]。
体外评价在一致性评价中作为一个重要部分单独列出,足见其重要程度。对于新注册分类的仿制药,虽然没有明确的要求,但是贯穿于处方工艺开发、质量研究和稳定性考察等整个研究过程的始终。体外评价在确定参比制剂选择合理性的基础上开展,包括质量一致性评价和溶出曲线相似性评价两个主要部分。
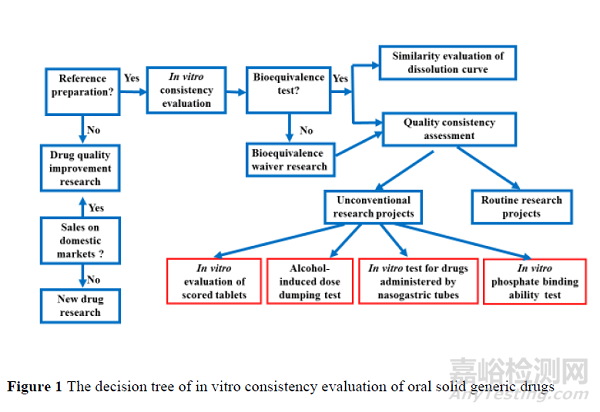
1 质量一致性评价
1.1 常规项目的研究
国内外药典标准收载的项目通常是常规的、必须进行研究的项目,一般包括有关物质、含量、溶出度和含量均匀度等关键质量属性。对于手性药物还应研究异构体杂质,多晶型药物应进行晶型种类或晶型纯度的研究[5]。一般要求列举多批自制品和多批参比制剂的检测数据,评估分析自制品和参比制剂的质量一致性,并提供详细的杂质谱分析,关注检出值较大的未知杂质在后续稳定性考察中的降解趋势。
1.2 基于产品特性的研究
部分品种参比制剂的用法用量、给药方式、体内释药特点和作用部位等具有特殊性,如参比制剂具有功能性刻痕、在体内药物释放具有乙醇诱导的剂量倾泻风险,可以通过鼻胃管给药和肠道局部用药不易进行体内BE 研究等,这些特性对药物的质量可控性、安全性和有效性有重要影响,为达到与参比制剂的质量和疗效的一致性、满足临床使用中的可替换性,仿制药也需要进行相应的外观设计和质量研究,下文结合国内外指导原则和具体案例分析这些非常规研究项目的技术要求和关注点。
1.2.1 功能性刻痕片的设计和一致性研究
对参比制剂的质量特性研究时,还应关注药片是否有刻痕,并根据说明书上用法用量描述判断是否为功能性刻痕。如25 mg 规格卡托普利片一面有十字刻痕,原研说明书明确标示有半片及1/4 片掰片用法;部分缓释片如单硝酸异同山梨酯缓释片上有一字刻槽,说明书描述“药片可沿刻槽掰开,服用半片”。类似上述具有计量分割功能的刻痕均为功能性刻痕。为了充分保证临床使用中的可替换性,仿制片剂应设计同样的功能性刻痕,并进行分割部分与整片的质量一致性和稳定性研究。若参比制剂未带功能性刻痕设计,仿制片剂不建议设计功能性刻痕[6]。药片的形状、大小、刻痕的设计和分割方式等均可能影响分割部分的质量,应参照《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则》[7],并结合参比制剂的相关信息等设计具有准确分割功能的刻痕,在产品的开发、放大研究和验证过程中均应进行分割部分的体外评价研究,考察项目通常包括重量差异、含量均匀度、分割重量损失、脆碎度和溶出度,缓控释制剂还应在拟定的整片硬度范围的上、下限分别取分割后部分与整片进行溶出曲线相似性研究。若研究表明刻痕片质量符合要求,这些体外评价项目可不作为常规检查项目[药研公众号整理排版]。
1.2.2 乙醇诱导的剂量倾泻的一致性研究
口服调释制剂由聚合物基质或包衣来控制原料药的释放,若与含酒精的饮料一同服用,可能会引起控制释放的聚合物提前溶解或变性,造成药物过快释放,发生剂量倾泻,进而影响药物的安全性和有效性,尤其是治疗窗窄的药物甚至造成死亡。因此,对于仿制药,EMA 指南[8]要求所有口服调释制剂均开展乙醇中剂量倾泻试验。FDA 生物等效性部门对所有阿片类调释制剂及其他易于发生剂量倾泻风险的调释制剂要求开展乙醇中剂量倾泻试验。FDA 特定药物生物等效性指导原则明确了需要进行剂量倾泻试验的品种和具体方法,如盐酸氢吗啡酮缓释片[9]、琥珀酸美托洛尔缓释片[10]和盐酸文拉法辛缓释片[11]等口服调释制剂。对于口服调释制剂而言,乙醇中剂量倾泻试验实际是仿制药与参比制剂在不同浓度乙醇的溶出介质(必要时高转速)条件下溶出/释放曲线一致性对比研究,以评价仿制药在体内酒精环境中出现药物突释的可能性及与参比制剂释放行为是否相似。如果仿制药释放加快,且速率与参比制剂不相似,应重新开发处方。某些特定情况下可能需要进行制剂与酒同服时的BE 试验[12]。实际上体内乙醇诱导的剂量倾泻受多种因素的影响,体外试验评估与体内复杂因素的相关性是应关注的问题。EMA 和FDA 提供了乙醇诱导的剂量倾泻试验方法,但试验条件也不完全一致,如FDA 要求考察40%乙醇浓度,EMA 未规定取样时间等。因此,应综合考察原辅料性质、处方设计、适应症、剂量倾泻风险的评估及参比制剂的特性等因素选择乙醇浓度、转速和取样时间间隔等试验条件。
1.2.3 鼻胃管给药的一致性研究
部分原研口服固体制剂如替格瑞洛片、利伐沙班片、吉非替尼片和兰索拉唑迟释口崩片等,说明书描述对于无法整片吞服的患者可经鼻胃管给药,即将药片研碎后与水、葡萄糖溶液、果酱和果泥等稀释剂混合后经鼻胃管给药[13,14]。鼻胃管给药较整片口服可能会造成实际给药量减少,影响进入胃的药物状态(如沉降体积、粒径分布等),进而影响药物的溶出或释放,以及体内生物利用度和疗效;同时药片被研碎后制成混悬液也会增加质量不稳定性的风险。因此,仿制药和参比制剂的鼻胃管给药体外对比评价是体外一致评价的重要内容。考察项目通常包括沉降试验、粒径分布、回收率和稳定性等,在进行试验设计时可参照FDA 个药指南推荐的方法,并结合产品的特点进行风险评估,选择的试验条件应涵盖最差条件。对于释放或吸收受pH 值影响较大的药物,应使用不同pH 值的介质进行体外对比试验,如兰索拉唑迟释口崩片[15]的个药指南草案中要求在不同pH 值(5.5、7.0 和8.5)的介质中进行崩解时限、沉降体积和回收率等试验。
1.2.4 体外磷结合力的一致性研究
磷酸盐结合剂是降低血磷浓度的常用药物,影响该类制剂在胃肠道内与磷酸根结合能力的因素较多,包括药物的溶出和分子离子形态、磷酸根的浓度、胃肠道的pH 值及药物在胃肠道各部分的停留时间等,因此溶出曲线相似并不代表磷结合力一致。同时考虑到该类制剂为胃肠道局部作用,口服不吸收,不易进行BE 试验,故通常推荐体外磷结合力考察(即磷结合动力学试验和磷结合平衡试验)作为等效性评价的一种方法。目前国内外尚无磷结合力考察的指导原则,FDA 个药指南推荐了此类制剂磷结合力试验的方法,如碳酸镧咀嚼片[16]、碳酸司维拉姆片[17]和枸橼酸铁片[18]等。文献[19]对相关要求进行了综述,总结了需要关注的问题。可参照上述资料开展磷结合力试验,并应考虑可能影响磷结合剂与磷酸根结合的因素。首先,处方组成和工艺可通过影响片剂硬度、崩解时限和胃肠道pH 值等因素,影响药物在胃肠道内与磷酸根的结合,应以原研品为基础进行充分的筛选研究。其次,设计合理的磷结合力试验方案,建立良好的体内、外的相关性,比如选择不同pH 值介质时应体现胃肠道各段pH值的差异,关注药物作用部位的pH 值,且整个试验过程中要保持pH 值稳定减小对磷结合的最大平衡浓度和动力学曲线的影响;考察用介质体积应结合规格不同进行调整;咀嚼片应同时考察整片吞服和模拟咀嚼后(粉碎)服用对磷结合力的影响等。同时,个药指南均要求至少选用自制品和参比制剂各12 个制剂单位进行试验,对于可能存在批间差异的品种如碳酸司维拉姆片,选择的制剂数量应能支持最终的数据分析具有统计意义。通常推荐选用专属性良好的分析方法如离子色谱法,并进行全面的方法学验证,注意线性和准确度的验证范围是否涵盖磷结合的实际浓度,不同pH 值的介质中均应进行必要的方法学验证等。
2 溶出曲线相似性评价
2.1 溶出条件的筛选
溶出曲线的溶出条件和检测方法可以参照已经建立的溶出度条件和方法,在此基础上结合产品特点筛选具有良好区分力的溶出条件。为使难溶性药物达到“漏槽条件”,通常考虑增加表面活性剂,随规格增大需加入表面活性剂的量也可能增大。如利伐沙班片有10、15 和20 mg 3 个规格,FDA 溶出方法数据库推荐10 mg 规格的溶出介质为0.2%十二烷基硫酸钠(SDS)的pH 4.5 醋酸盐缓冲液,15 和20 mg 规格的溶出介质为0.4% SDS的pH 4.5 醋酸盐缓冲液[20]。若以20 mg 规格BE 试验来豁免10 和15 mg 规格的BE 试验,15 和20 mg 规格应进行0.4% SDS 的溶出介质中溶出曲线相似性研究;而10 和20 mg规格推荐的SDS 浓度不同,在选择溶出介质时应避免主药与表面活性剂浓度比例不同造成的溶出量差异,可考虑选用2 片10 mg 规格与1 片20 mg 规格在0.4% SDS 的溶出介质中[21],或10 mg 规格在0.2% SDS 的溶出介质中与20 mg 规格在0.4% SDS 的溶出介质中进行溶出曲线相似性研究。
2.2 溶出曲线研究的常见问题
多批自制品的溶出曲线批内差异大,而参比制剂的溶出曲线批内均一性良好,提示自制品的质量有问题,应进行处方工艺改进。若参比制剂也存在溶出曲线批内差异大的问题,还应考虑溶出条件选择的是否合适,如转速过低、溶出杯底部易出现堆积物,造成溶出杯内溶出量空间差异大,此情况可以通过提高转速进行改善;溶出介质体积过小不能使难溶性药物充分溶解,取出的溶出液中含有未溶解的药物颗粒,在样品处理过程中药物从颗粒中逐渐溶出,因处理时间不完全一致导致批内溶出量的差异,该情况可以通过增大溶出介质体积进一步研究,必要时可考虑加入表面活性剂等方式进行优化。
获批上市的产品若发生了可能影响产品溶出行为的变更,如原料药的晶型或粒度变更,处方中黏合剂和崩解剂等种类、用量或供应商变更,混合、压片和包衣的设备、工艺参数变更等,为考察变更前后产品质量的一致性,除质量标准的考察项目外,还应开展变更后产品和BE 批自制品在多种介质中溶出曲线相似性试验。若BE 批自制品已不在有效期内,也可以与原BE 批自制品的溶出曲线数据进行对比,前提是溶出条件和方法未进行变更,可见建立科学合理、适用性好的溶出条件和方法具有重要意义。同时,溶出曲线相似性研究数据的统计、整理和呈现也至关重要,可参照文献[22]进行整理和提交。
3 BE 豁免品种的体外研究
BE 豁免一般分为两类,一类是基于生物药剂学分类系统(BCS)分类的BE 豁免,一类是多规格间的BE 豁免。两种情况均要进行多种pH 值的介质中溶出曲线相似性研究,但关注点不同,基于BCS 分类的BE 豁免要证明多批自制品和与参比制剂在多种介质中溶出曲线相似,而多规格间的BE 豁免需要证明拟豁免规格与BE 规格在多种介质中溶出曲线相似。多规格间的BE 豁免应满足拟豁免规格和BE 规格的处方比例相似,对于“高活性物质”、“活性成分和非活性成分非等比例变化的处方比例相似”的判定,国内指导原则[12]未给出明确标准。参照EMA 和FDA 相关指导原则[21,23],可以将高活性物质理解为活性成分的含量在片芯/胶囊内容物的占比小于5%;对于活性成分和非活性成分非等比例变化的多规格处方,若非活性成分相对于单剂量处方的比例的变化幅度在辅料用量变更中的Ⅱ类变更允许的范围内(±10%),也属于处方比例相似。拟豁免规格非活性成分的变化幅度是以BE 规格处方为基准计算的,先计算拟豁免规格和BE 规格的非活性成分相对于单剂量处方的比例,后计算两个规格间的差值。当处方中非活性变化种类多于一种时,非活性成分的变化幅度应为各非活性成分变化量的绝对值之和。以多规格普通片处方为例说明“处方比例相似”标准的应用,处方见表1。
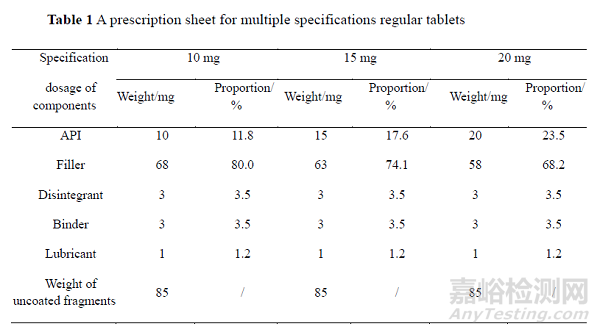
20 mg 规格为BE 规格,拟申请10 和15 mg 规格BE 豁免。3 个规格的活性成分均大于5%,不属于“高活性药物”,故按照“活性成分和非活性成分非等比例变化的处方比例相似”的标准判断。3 个规格处方中唯一比例不同的非活性成分为填充剂,10 mg规格与BE 规格的非活性成分变化幅度为11.8%,超出±10%范围,不属于处方比例相似,而15 mg 规格与BE 规格的非活性成分变化幅度为5.9%,属于处方比例相似。
4 无法推荐参比制剂品种的体外研究
无法推荐参比制剂的情况有多种,如临床价值不明确的品种、原研品信息不明确的国内特有品种、原研品因停产或因质量等原因不适合作为参比制剂且无国际公认同种药物的品种、经国家药品监督管理局评估认为在安全性、有效性和质量可控制性上存在问题的品种等。无法推荐参比制剂的情况中部分品种具有明确的临床使用价值,国家药品审评中心整理并发布《临床价值明确,无法推荐参比制剂的化学药品目录(第一批)》(征求意见稿)[24],收载了近30 多种口服固体制剂,如葡萄糖酸钙片、铝镁加咀嚼片和氨酚美素软胶囊等。在此基础上,起草了《第一批拟不推荐参比制剂化药品种药学研究技术要求》(征求意见稿)[25],包括了13 种口服固体制剂。对于这类药物,除不要求进行与参比制剂的质量和疗效一致评价外,均要求参照现行各国药典标准、药学研究技术要求及相关指导原则等进行质量提升研究。对于未在国内上市的品种,应按照创新药的技术要求开展研究,特殊情况下还需进行临床有效性试验[药研公众号整理排版]。
5 小结
口服固体仿制药的体外一致性评价作为质量一致性研究的重要组成部分,除常规考察项目和溶出曲线相似性研究外,基于产品特性需进行一些非常规项目研究,如功能性刻痕、乙醇诱导的剂量倾泻、鼻胃管给药和磷结合力等。本文结合具体案例,对非常规项目、溶出曲线相似性研究及无法推荐参比制剂的仿制药的质量提升等研究中常见问题和关注点进行汇总分析,基于目前的法规指南和技术要求提出了相应的解决方案和处理建议。随着科学技术的进步,监管要求的提升,体外一致性评价的技术要求也会不断更新,应及时开展研究,保证产品在批准后的整个产品生命周期达到与参比制剂质量一致。

来源:Internet


