您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-02 17:06
药物的研发始终包括化合物和制剂两个方面,但长期以来,新分子实体的开发一直是药物开发的重点。但随着创新药(新分子实体)开发的难度越来越大,越来越多的制药公司谋求在新剂型的开发上的获得突破。为了认清制剂的发展方向,从宏观层面追寻上市药物的制剂发展历程和现状无疑是重要的途径。有研究者对FDA批准的所有上市药物(截止2017年)的剂型进行了全景分析。笔者特对其进行翻译,以飨读者。
1. 前言
对于药物开发而言,最为关键的两个方面为新分子实体的研发和新剂型的开发。近年来,新分子实体的产出率持续低迷,与研发支出存在明显的差距。虽然新分子实体的开发成本以每年13.4%的平均速度显著增长,但新分子实体在临床试验中的成功率却仅为10%左右。在2017年,只有46个新分子实体被美国食品药品监督管理局(FDA)批准。新分子实体开发的现实,让许多制药公司更加专注于药物传递系统的开发。新剂型的开发费用远低于新分子实体的开发。另一方面,目前临床上很多药物,由于溶解性,稳定性和靶向性等问题,还远未达到最佳治疗效果。基于此类药物,开发新剂型及给药系统可以提高药物治疗效果,降低毒副作用并改善患者依从性。此外,新型药物传递系统可以大大延长新分子实体的生命周期。
过去60年,制药业经历了巨大变革。在制剂方面,以药物传递系统为代表的新剂型表现最为突出。表1列出了药物传递系统发展历程中的里程碑事件。第一代(1950-1980年)药物输送系统(例如,口服缓释制剂、吸入剂和透皮贴剂)从研究到上市的产品转化效率高。早在1952年,Spansule®首次实现了12小时的持续释放。四年后,加压定量吸入制剂(MDI)产品的上市标志着吸入剂开始进入市场。1979年,透皮贴剂Scop®获得批准。第二代药物传递系统的开发目标主要集中在纳米药物和智能给药系统上。尽管第二代(1980-2010)药物传递系统(例如,脂质体,纳米颗粒,微球和基因传递)的开发获得极大关注,但是到目前为止,上市产品非常有限。脂质体Doxil®于1995年获批,是第一个纳米药物。Abraxane®在2005年上市,也是第一种基于纳米技术的给药系统产品。这些药物传递系统在商业上取得了较大的成功,也吸引着众多追随者。
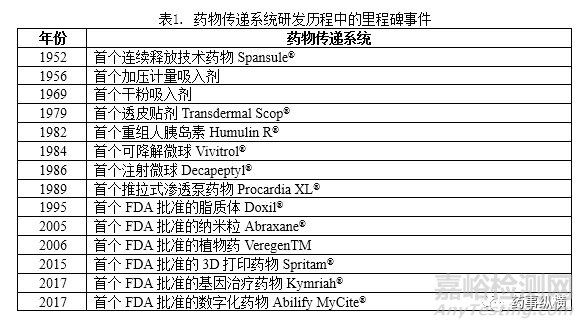
1984年,FDA颁布的《药品价格竞争和专利期限恢复法》标志着创新药和仿制药的竞争开始。随后便建立仿制药的申请流程,仿制药产品只需要证明其与原研药物具有生物等效性便可以上市。自此,仿制药市场增长趋势显著,而创新药的研发也由于高收益得以持续。自1990年代以来,新药专利保护期限和仿制药进入市场之间已达到平衡。
到目前为止,FDA已经批准了34,673种药物产品,包括114种给药途径和169种剂型。毫无疑问,对这些获批药物进行深入分析将大大促进我们对药物传递系统和剂型的理解。本项研究的目的正是为FDA批准的药品展示全景分析图。首先,对给药途径和剂型的整体情况进行了分析。在此基础上,进一步分析了几种先进的药物输送系统,包括口服控释制剂,吸入输送系统,透皮贴剂和复杂注射剂。最后,探讨了药剂学的未来和发展前景。
2. 数据收集与分析
药品数据摘自第38版FDA橙皮书和@Drug数据库。该研究包括了所有被FDA批准的单一药物产品。在本分析中,“单个”表示药品具有不同的批准号(如图1所示)。文献数据摘自《科学引文索引》(SCI-E)数据库,时间为在1980年1月1日至2017年12月31日,通过关键字搜索策略获取相关信息。所有临床数据均来自世界上最大的临床试验注册网站(https://clinicaltrials.gov/)。
本研究的目的在于研究现有药物的分布情况,因此只将上市药物品种纳入了数据检索范围。首先对制剂进行了宏观分类。给药途径分为口服、注射、吸入、黏膜、透皮和其他。然后对每个给药途径下的剂型分布进行了分析(如果一个药物包含不同的剂型,则分别计入)。
基于宏观分析结果,进一步探讨了先进药物传递系统的研发历程。主要对口服缓释制剂、吸入剂、透皮贴剂和复杂注射剂,研究投入/上市产出的转化率和给药系统的特征进行了探讨。
3.药品概述
3.1 每年上市和退市药物概况
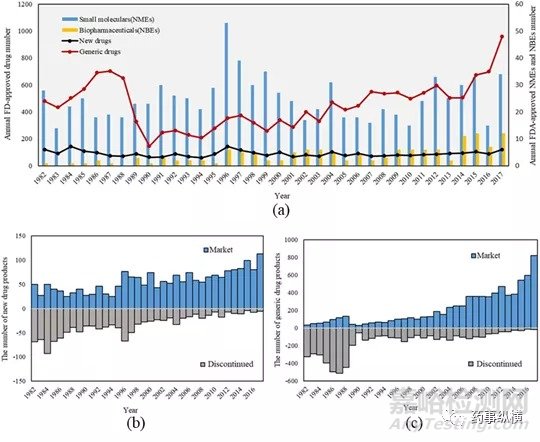
图1.(a)FDA每年批准的药品数量;(b)每年上市和退市的创新药数量;(b)每年上市和退市的仿制药数量。(蓝色代表市售药品,灰色代表停产的药品)
截至2017年,FDA总共批准了34,673种药品。图1(a)展示了1981年至2017年每年药品批准的数量。在此期间,每年新药的批准量(包括新分子实体,活性成分,剂型,组合,制剂和适应症)相对稳定。新药批准量在1996年出现了一个小高峰,这可能与1992年发布的处方药使用者付费法案导致申请积压有关。此外,图2(a)也可以看到生物药的批准情况。自从1982年FDA批准了第一种生物药(HumulinR®)以来,生物药的获批数量呈现显著的增长趋势。在2017年,获批新生物药实体几乎占到了整个获批的新分子实体中的四分之一。这些获批的生物药,满足了大量未满足的临床需求。基因和细胞疗法引起了广泛的关注。例如,第一个基因疗法Kymriah®已经被FDA批准。
总体上看,仿制药批准数量呈现显著的增长趋势。自1982年开始,曲线维持在较高水平并呈上升趋势。1988年,《哈奇·韦克斯曼修正案》颁布后,曲线达到了顶峰。从1988年到1990年,仿制药的批准数量急剧下降。1990年代以后,批准的药品数量恢复到稳定水平。2014年之后,仿制药获批数量又开始显著增长,这可能与创新药研发和成本控制的难度不断提高有关。此外,生物药的专利到期也为所谓的生物类似物打开了大门。例如,第一个生物类似物(Zarxio®)在2015年被FDA批准。由于几个重磅的生物药的专利到期,生物类似物市场持续增长。截至2017年,FDA共批准了10种生物类似物。此外,FDA在2018年7月28日发布了《生物仿制药行动计划》,以促进生物类似物的高效开发。
图2(b)和(c)分别展示了每年上市和退市的创新药和仿制药。显然,新药的生命周期要比仿制药更长,早期的仿制药也更可能退市。退市的原因也多种多样,包括安全性问题、副作用、有效性问题、生产问题,监管变化或财务原因等。
3.2 给药途径分布情况
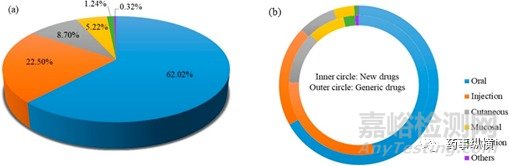
图2.(a)FDA批准的药物的给药途径的总体分布;(b)给药途径的比例内圈代表药品;外圈代表仿制药
图2展示已上市药物的给药途径分布。其中,口服给药途径(62.02%)占比最大,然后是注射(22.43%),皮肤(8.70%),粘膜(5.22%),吸入(1.21%)和其他(0.42%)(图3a)。口服给药仍然是最有吸引力的给药途径,由于其患者的依从性高且易于给药。与创新药的开发相比,仿制药的开发更倾向于选择传统给药途径下的药物。例如,口服仿制药占所有仿制药的比例已远远超过60%(图3b)。
仿制药与创新药的比率可以用于评估技术壁垒和市场容量的大小。一般来说,技术壁垒越低,市场容量越大,仿制药与新药的比例就越高。表2显示了不同给药途径的仿制药和新药比率值(口服:4.69>注射:2.30>皮肤:2.03>粘膜:1.61>吸入:0.97)。最高比例的口服给药系统意味着技术壁垒最低。因此,在专利到期后,仿制药上市,相应的创新药更容易在市场上陷入困境而苦苦挣扎。相反,低比率值的吸入给药系统显示出较高的技术障碍,因此新的吸入药品可能享有更长的市场独占期。
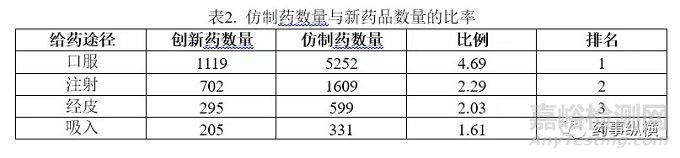
3.3 剂型分布情况
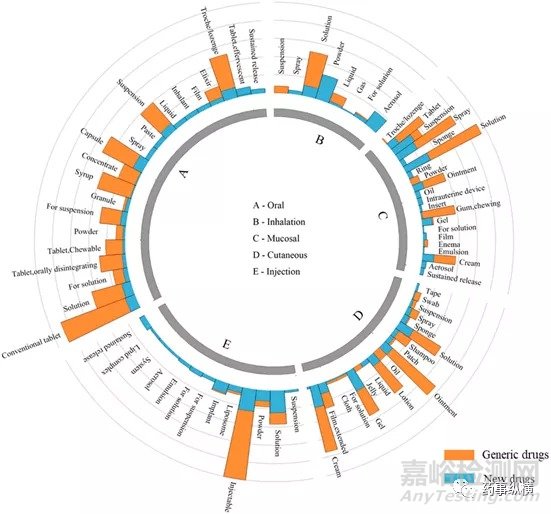
图4.不同给药途径药物的剂型分布图(橙色代表仿制药数量,蓝色代表新药的数量)
图4展示了各个给药途径下药物的剂型分布。从总体上看,口服药物的剂型选择和设计最为灵活。吸入制剂的剂型选择却很局限,其往往涉及到复杂的处方和给药装置。创新药的剂型比仿制药剂型更加多样化。仿制药主要集中在常规剂型上,而创新药却更有可能采用新的剂型进行开发。
口服制剂:由于给药便利性和较高的患者依从性,口服给药已成为给药系统开发的首选。药物口服后,必须首先从制剂中释放药物,将其溶解在胃肠液中并通过胃肠膜吸收。与其他给药途径相比,口服给药在制剂剂型设计方面显示出更大的灵活性,几乎包括从溶液、悬浮液、乳液、粉剂、颗粒剂、胶囊剂到片剂等的所有剂型。仿制药数量与创新药数量的高比例也表明口服制剂已发展到成熟阶段。几乎所有口服药物都有大量的仿制药。例如,口服缓释制剂的仿制药数量几乎是创新药的四倍。但是,有几种新的剂型却没有没有仿制药竞争,例如,供吞咽困难病人服用的口服液体RavictiTM,口服可溶性膜Zuplenz®和泡腾片BinostoTM。这可能是由于制剂专利缘故。这表明制剂专利也是延长药物生命周期的重要工具。例如,Zuplenz®是使用PharmFilm®技术开发的恩丹西酮的特殊制剂。这项技术在2010年获得了美国专利,为公司的膜产品及其制备方法提供了知识产权保护。因此,Zuplenz®可以享有长期的市场独占权。
注射制剂:注射剂主要包括注射液和注射用粉末,能够使药物直接进入血流,快速发挥药效,甚至靶向特定的器官和组织部位。在3.2节中的分析表明,注射给药制剂相对容易仿制。例如,普通注射剂的数量占注射剂总数量的90%以上,其中,仿制药的数量是这些简单创新药数量的三倍以上。但是,复杂注射剂的仿制药却很少(例如,脂质体,乳液,悬浮液,微球,纳米粒和植入物),因为这些复杂的制剂具有很高的技术屏障。我们将在4.4节中对复杂制剂进行深入分析。
透皮制剂:透皮给药过程使药物穿过皮肤屏障,产生局部作用或全身循环。透皮制剂适合外部使用。大多数透皮给药药物是常规剂型(例如,霜,溶液,软膏和乳液),这些药物都容易仿制。但是,目前市场上仅有54种透皮贴剂(28种新药和26种仿制药),这表明透皮贴剂具有相对较高的技术壁垒。
粘膜制剂:粘膜给药途径(例如鼻,颊,眼,阴道,直肠,舌下和子宫内)比其他给药途径有很多好处,例如非侵入性给药,能够迅速起效和避免肝首过代谢。当前市售的粘膜制剂主要是溶液剂、喷雾剂、片剂、软膏剂、乳膏剂和咀嚼剂,这些剂型占到了总量的84%,这些产品的仿制相对容易。
吸入剂:吸入剂起效快、药物作用可控。总体而言,与其他给药途径相比,吸入给药制剂最难仿制。图4中的数据显示,吸入制剂的仿制药主要集中在液态吸入制剂(溶液,悬浮液和液体)。气雾吸入剂、干粉吸入剂和喷雾吸入剂几乎没有仿制药,处方/设备组合的技术壁垒很高,因此享有一定的市场独占期。
4. 先进的给药系统分析
目前,临床许多药物使用了第一代给药系统(1950-1970),相应的技术已经达到了成熟阶段。而第二代给药系统(1980-2010)却存在较高的技术壁垒,在临床上应用的产品较少。这些先进的给药系统(DDS)在学术界和工业界都得到了广泛的研究。在过去的三十年中,关于新型给药系统的文献数量和临床试验量急剧增加。但是,在药品产出和研究投入之间却又有明显的差距。对于这些具有高技术壁垒的先进制药技术,分析其临床成功率和转化效率是必要的。为此,本文收集了几种具有较高技术壁垒且广泛应用的给药系统的相关数据(表3),包括口服缓释制剂、透皮贴剂、吸入剂(气雾剂,干粉剂和喷雾剂)和复杂的注射剂(脂质体、乳剂、微球、纳米颗粒和纳米混悬剂)。
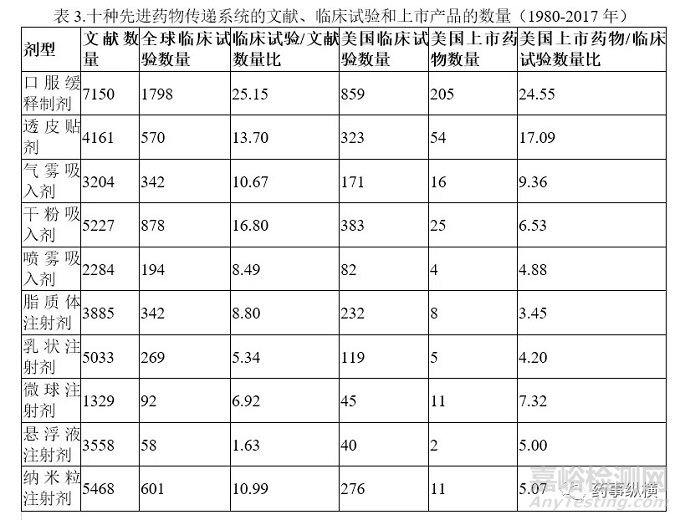
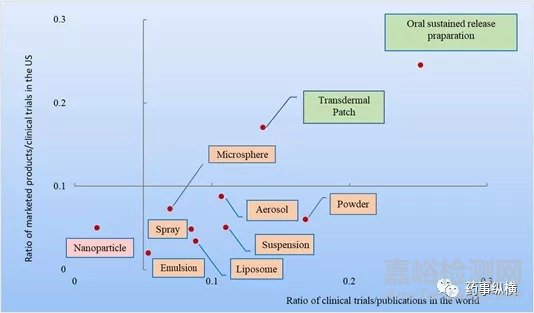
图5. 十种先进给药系统技术的四种分类
在图5中,根据两个参数(全球临床试验和全球文献数量之间的比率以及FDA批准的药品与美国临床试验的比率)将10种给药系统技术分为4种类型。横坐标全球临床试验和全球文献数量之间的比率代表转化率。纵坐标FDA批准的药品与美国临床试验的比率表示累积的临床成功率。横纵坐标分别以5%和10%为界限,将这些给药系统分类。全球临床试验和文献的比率为5%,代表了从学术研究到临床试验的转化效率的关键点,而10%的临床成功率是过去20年新分子实体的平均临床成功率。据这个划分标准,可以将这些先进的给药系统分为四类。第一类是具有转化效率和高临床成功率的技术,包括透皮贴剂和口服缓释制剂。第二类是具有低转化效率和高临床成功率的技术,很遗憾,没有给药系统技术属于此类。第三类具有高转化效率和低临床成功率,包括吸入剂(气雾剂、干粉剂和喷雾剂)和复杂的注射剂(乳液、脂质体、纳米颗粒、悬浮液和微球)。第四类具有非常低的转化率和临床成功率,例如纳米颗粒。
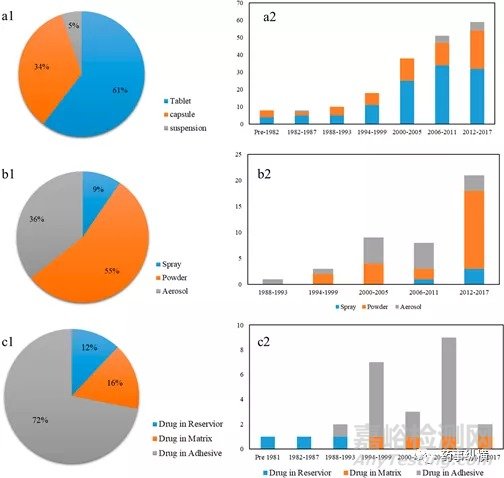
图6.(a1)上市口服缓释药物的剂型(片剂、胶囊剂和悬浮液)分布;(a2)口服缓释药物的剂型随上市时间的演变。(b1)上市吸入剂(喷雾剂、干粉剂和气雾剂)的剂型分布;(b2)上市吸入剂的剂型随上市时间的演变。(c1)上市的透皮贴剂的剂型(药物处于储库、基质或粘合剂中)分布;(c2)透皮贴剂随上市时间的演变。
4.1 口服缓释制剂
口服缓释制剂控制药物以设定的速率释放,以此维持血浆中或作用靶点位置的药物浓度,进而延长治疗效果。1952年,史密斯·克莱恩(Smith Kline)和弗朗西斯(French)研发出第一种口服缓释药物(Dexedrine®),药物持续释放时间为12小时。与传统剂型相比,Dexedrine®具有独特的优势,包括减少给药频率,改善患者依从性和减少副作用。Dexedrine®的在商业上的成功促进了缓释技术的进一步发展。随后,研究者们建立了四种不同的药物释放机制,进一步加速缓释制剂的开发。这些机制包括溶出控制、扩散控制、渗透控制和离子交换。几种新型的口服缓释技术产品已经进入市场。基于渗透泵技术的Procardia XL®于1989获批上市。渗透泵技术通过调节环境与药物系统之间的渗透压差来实现不同的药物释放行为。基于GeomatrixTM技术的Sular®于1995年上市。这种片剂由含药层和迟滞层组成。含药层的两侧均被迟滞层覆盖。药物释放取决于含药层和迟滞层的比例。2005年,基于AcuformTM技术的Glumetza®可以使活性成分在小肠上部被吸收,并具有持续释放的作用。
截止2017年,共有192种口服缓释制剂上市,剂型主要包括片剂、胶囊剂和混悬剂。如图5a所示,口服缓释片剂占据最大份额,为61%,其次是胶囊剂(34%)和混悬剂(5%)。图6b表明口服缓释制剂的市场显示出稳定增长趋势。4.2 吸入给药制剂
肺具有树枝状结构,拥有许多特性,例如巨大的表面积(100平方米)、丰富的毛细血管和相对较少的代谢反应。因此,肺部给药具有全身和局部药物传递的强大能力。目前,市场上有三种吸入剂,包括定量吸入气雾剂(MDI)、干粉吸入剂(DPI)和喷雾剂。
3M公司于1956年获批了第一个吸入剂,为MDI,用于支气管哮喘的治疗。MDI由推进剂、药物和添加剂组成(例如,溶剂,乳化剂等)。给药装置通过阀门系统较为准确地控制治疗剂量。其会造成臭氧层破坏,作为推进剂的氟利昂已经被禁止使用。FDA在1994年批准了两种氢氟烷烃(HFA134a,HFA227)替代氟利昂。同时,干粉吸入剂Norisodrine®在1971年被开发出来。对于干粉吸入剂,需要将药物颗粒尺寸控制在特定尺寸。药物和载体以胶囊,泡罩等多种剂型保存。与其他肺部给药的剂型相比,干粉吸入剂具有一些优势,包括易于携带,更少的清洁步骤和较低的污染风险。但是,干粉吸入剂的药物释放和吸收在很大程度上取决于患者的吸入。
目前已经开发出许多用于治疗哮喘和慢性阻塞性肺疾病(COPD)的药物。60多种吸入产品已经上市(气雾剂,干粉剂和喷雾剂)。在这些药物中,干粉吸入剂占55%,其次是气雾剂和喷雾剂,分别占36%和9%。显然,自2011年以来,气雾剂数量呈下降趋势,这与氯氟烃吸入器的停产有关。另一方面,干粉吸入剂在2012年至2017年之间迅速上升,显示出巨大的市场前景。
肺部给药在肽或蛋白质的给药上也具有特殊的优势,例如能够快速吸收、蛋白酶的干扰较少。Exubera®(辉瑞)和Afrezza®(Mannkind),都是胰岛素的吸入剂,分别在2006年和2014年获批。但是,这两种产品由于生物利用度低和患者依从性差而未能获得商业成功。
4.3 透皮贴剂
皮肤的结构由角质层、表皮和真皮组成。通常,透皮贴剂中的药物通过角质层和表皮进入真皮,真皮中分布着血管,药物被这些血管吸收而进入体循环。
透皮贴剂主要包括三层,包括防止药物流失的封闭背衬层,用于储存药物的含药层(支撑层)和用于保持贴剂与皮肤接触的黏合层。葛兰素史克公司的TransdermScop®是首个获得FDA批准的透皮。包含的药物为东莨菪碱,用于防止晕车和恶心呕吐,持续时间长达3天(72小时)。TransdermScop®进入市场后,越来越多的活性物质被开发成透皮贴剂。根据药代动力学原理,目前的透皮贴剂可分为三种类型,包括粘合剂分散型,基质扩散型和储库型。
截至2017年,已经上市了28种透皮贴剂。如图6c所示,透皮贴剂中有72%的品种的药物包含在粘合层中,而基质药中包含药物的透皮贴剂占16%,储库中包含的透皮药物的透皮贴剂仅为12%。所有上市的储库贴剂均在1999年之前获得批准,这是因为药物从储库中的释放往往不受控制。
4.4 复杂注射剂
从以上分析可以明显看出,复杂的注射剂转化率和临床成功率均较低。在这一部分中,将进一步讨论四种复杂的注射制剂,包括脂质体,乳剂,纳米颗粒和悬浮液(表4)。
表4. FDA批准的复杂注射剂列表(脂质体、微球、悬浮液、纳米粒和乳剂)
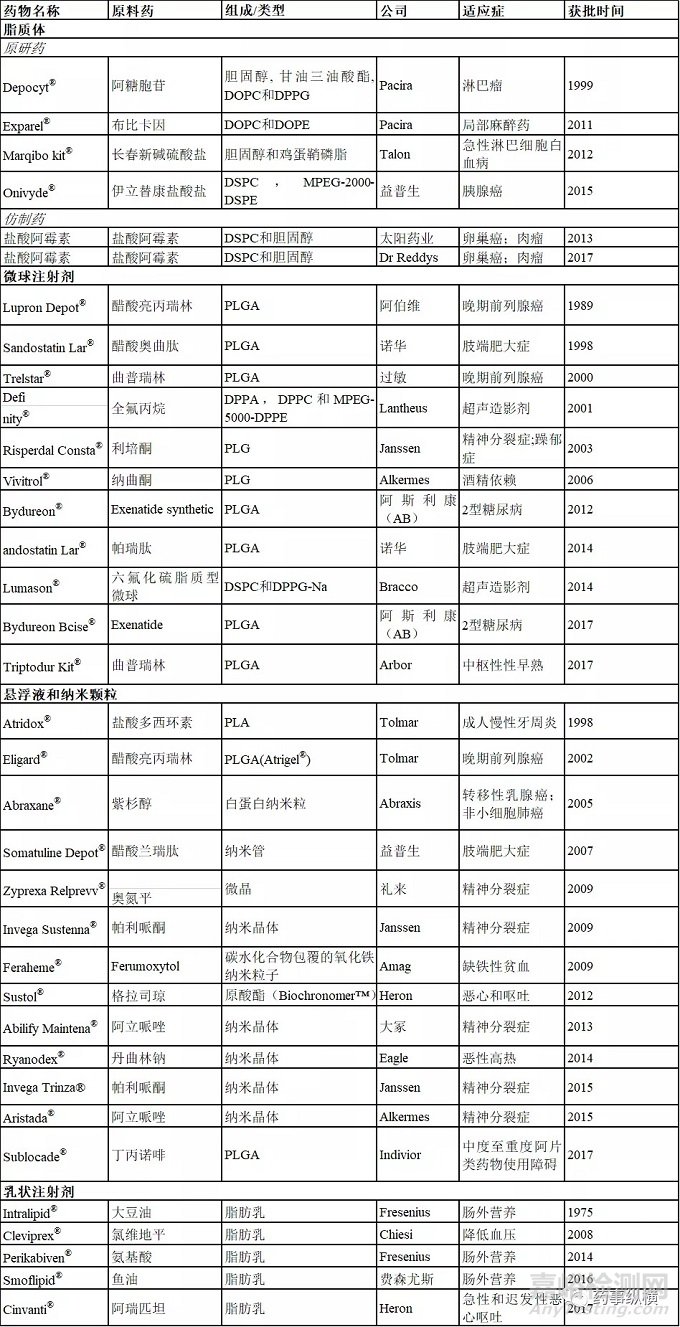
4.4.1 脂质体注射剂
脂质体是一种人工细胞膜,主要由天然或合成的磷脂(例如DLPC、DMPC、DPPC等)。药物被包裹在脂质体内部。随着脂质体逐渐降解,药物缓慢释放。
1995年,FDA批准了第一个脂质体注射剂Doxil®,其载有盐酸阿霉素,用于治疗卵巢癌,艾滋病相关的卡波西肉瘤和多发性骨髓瘤。与游离阿霉素相比,Doxil®受益于长循环半衰期(45 h)和被动靶向,进而显示出更为优异的治疗效果和更低的心脏毒性。
Doxil®在2001年的销售高峰达到了6亿美元,取得了巨大的商业成功。因此,许多制药厂进入了脂质体领域。Ambisome®在1997年被批准用于治疗深部真菌感染。Depodur®(2004)和Exparel®(2011)两种麻醉剂获批上市。Depocyt®(1999),Marqibokit®(2012)和Onivyde®(2015)被批准用于癌症治疗。FDA批准的十种脂质体药物,包括8种脂质体新药和两种仿制药。两种仿制药的上市,导致Doxil®自身的销量持续下降。
4.4.2 纳米颗粒和悬浮液注射
纳米颗粒是一种微观颗粒,至少在某一个维度上的尺寸小于100nm。上个世纪的90年代以来,纳米粒药物传递系统引起了广泛的关注。Abraxane®是一种结合白蛋白的紫杉醇纳米粒制剂,在治疗再生性乳腺癌方面取得了巨大的商业成就。相比于单纯的紫杉醇注射液,紫杉醇被制成Abraxane®的制剂后,获得了明显治疗优势。此外,Abraxane®不包含磷脂,可以避免脂质体容易引起的溶血反应。如今,共有13种悬浮液和纳米粒注射剂上市。在这些产品中,几种新技术药物引起了广泛的关注。InvegaTrinza®采用纳米晶体制备,会在很长一段时间内缓慢释放。采用Atrigel技术的原位凝胶成型系统的Sublocade®被认为是划时代意义的产品。
4.4.3 微球注射剂
微球是直径通常为1µm至300µm球形颗粒。开发持续释放的可注射微球的关键是如何选择合适的生物可降解聚合物。目前的上市产品主要使用合成聚合物。例如,作为合成聚合物,PLGA和PLA都是可生物降解且生物相容性良好。
武田于1985年开发了美国第一个上市的缓释微球产品(Luprondepot®)。Lupron depot®可以持续释放促性腺激素释放激素(GnRH)激动剂,用于晚期前列腺癌的姑息治疗。目前,市场上有11种FDA批准的缓释微球注射剂(表4中列出)。例如,SandostatinLar® Depot 解决了肽药物的短生物半衰期的问题,将给药期延长至4周并改善了患者的依从性。RisperdalConsta®解决了精神病患者的药物治疗困难和药物滥用问题。
4.4.3 乳状注射剂
乳液注射剂是两种或两种以上不混溶的油和水的胶体系统。乳液的稳定性取决于油和水界面的张力。Intralipid®是FDA批准的第一种注射用乳剂,获批时间为1975年,静脉给药后可以作为热量和必需脂肪酸的来源。Intralipid®是一种水包油乳液,卵磷脂作为乳化稳定剂。乳液有多重优势,例如增溶、保护、被动靶向和提高稳定性等。
5.未来展望
药物传递系统在药物研发中起着越来越重要的作用。先进的药物传递系统不仅可以提高药物效率,而且可以延长新分子实体的生命周期。我们的研究对FDA批准的药物进行了定量分析,并根据两个参数对技术障碍进行了讨论。第一代药物传递系统在市场上取得了巨大的成功,而第二代药物传递系统(脂质体,纳米药物和微球等)在过去的三十年中,尽管发表了大量论文和并投入了大量资金,但其实成功的案例却很少。建立药物基础研究到临床的桥梁对于药物科学家来说十分重要。
随着计算机和算法的发展,药剂学出现了一个新的领域——“计算药剂学”,该领域将人工智能、大数据和多尺度建模等应用到给药系统的处方设计中。当前的药物制剂开发主要采用费时费钱的试错模式。随着大量实验数据的积累,药物制剂的研发将从试错实验转变为数据驱动的人工智能开发。结合人工智能算法,可以很好地建立定量模型以进行处方设计。例如,已经使用神经网络技术建立了口腔崩解片(ODT)处方的预测模型。在这项研究中,从Webof Science数据库中的已发表论文中获得了总共145种处方,并被用于建立预测模型。结果表明,这种计算模型的准确性达到了80%。但是,随着药品的研发变得越来越困难,传统的研发模式面临着巨大的挑战。因此,如何利用数据对于药物制剂的未来发展至关重要。此外,分子建模方法也成为制剂设计的重要工具。可以通过计算活性物质与赋形剂之间的相互作用以及相关参数,以评估系统稳定性和结合强度,从而指导药物处方筛选并快速获得最佳处方。赵等人的研究成功地将分子建模和实验方法结合,获得了更好的叶黄素-环糊精多组分制剂。
开发用于药物递送的智能材料(例如,仿生材料)也是另一个重要领域。例如,脂质体模拟细胞膜用于药物递送、人白蛋白可用于纳米颗粒制剂(例如Abraxane®)。病毒样颗粒或细胞也是基因治疗的重要载体。FDA于2017年批准了首个基因疗法,即Kymriah®。该疗法药物由患者自身的白细胞制成,用于治疗急性淋巴细胞性白血病(ALL)。如何设计面向临床的新材料在药物输送中也起着越来越重要的作用。然而,尽管在过去30年中发表了许多有关药物输送材料设计的研究,但临床应用的案例非常少。
另一方面,新型的药物/装置组合也是药物传递系统的明智选择。近年来,从简单的压舌器到微芯片技术,微器件引起了越来越多的关注。吸入器械就是一个很好的例子,它是为溶液型吸入剂的使用而开发的。此外,3D打印技术为药物生产提供了更为灵活的路径。2015年,首次使用3D打印技术制成的药物是口腔崩解药Spritam®,被用于抗癫痫药。数字健康已被用来更好地管理和跟踪患者的健康状况。例如,带有可摄取事件标记的Abilifymycite®传感器于2017年获得FDA批准。当患者摄入药物后,他们的医生可以轻松追踪信号。
未来,新分子实体的研发可能会直接与先进的给药技术相结合,以获得治疗效果更佳的药物制剂。

来源:Internet


