您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-29 16:40
分析方法开发中破坏实验是大家长期关注的话题,如做哪些实验、破坏程度多大比较合适,最强破坏条件如何设置,基于一些期刊文献的查阅,表达下自己的观点,不足和错误之处,请同行批评指正。
一、为什么要做破坏实验
药物质量研究中,强制降解及其相关研究在稳定性指示方法的专属性研究中有重要意义,尤其是对潜在降解产物信息缺乏的情况下。这一研究可提供药品的储存过程中可能的降解途径及其产物的相关信息。强制降解试验可以从化学的角度对药品研发、处方优化、生产和包装过程提供指导意义。根据已有的相关指南,研究强制降解有以下原因:
● 用于稳定性指示方法开发
● 确定药物及其制剂的降解途径
● 确定处方中的降解产物来源于主成分或非活性成分(如辅料)
● 降解产物的结构确证
● 确定药物主成分的内在稳定性
二、如何做破坏实验
1如何确定破坏项目
破坏实验条件的设计应考虑药物的生产、储存、流通、使用等,采用较强的破坏强度,评估方法的检测能力。
药物在研发、生产、使用过程中,如药物溶出实验、工艺过程、服用过程均可能会接触到酸、碱,故需进行液体的酸、碱破坏;
药物的检测过程,均需配制成溶解状态进行,有些药物的制剂工艺会在高温条件配制成溶液状态,故需进行溶液状态的高温、光照破坏;
固体破坏是模拟大部分药物的储存条件,类似于影响因素实验(比加速试验更苛刻)。
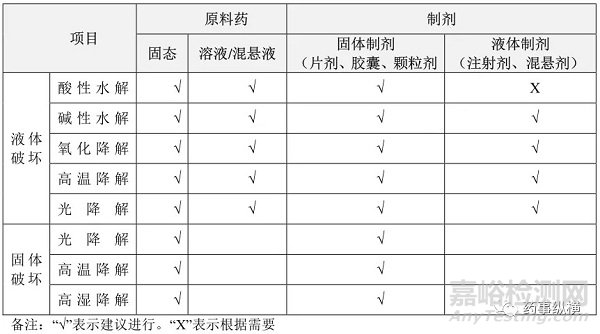
2如何确定破坏条件[2]
原料药可直接进行固体和液体的强降解试验,如固体高温、固体光照、液体酸碱水解、液体氧化等。制剂原则上需要同时进行API、空白辅料、制剂三者的平行强制降解试验,其目的为明确降解产物的降解途径。
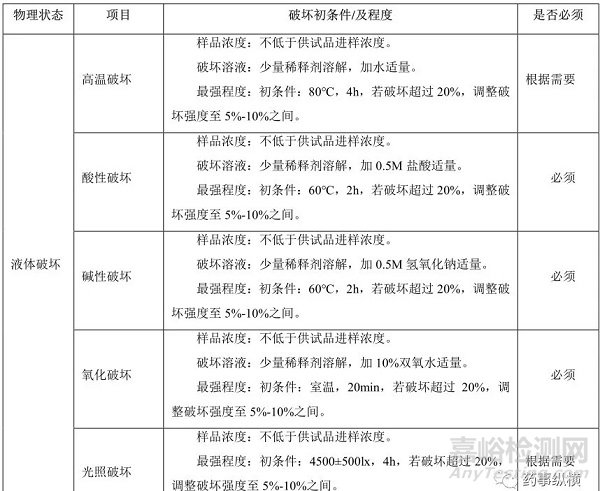
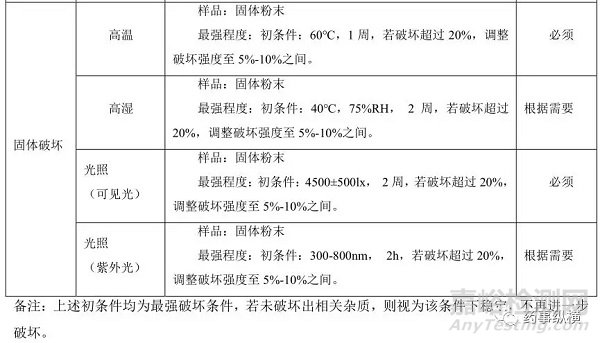
三、破坏实验的可接受标准
1降解试验----光谱纯度
降解试验需采用DAD或PAD检测器,依据光谱匹配度来衡量峰纯度,对于安捷伦检测器,峰纯度不得低于990,对于沃特世检测器,纯度角应小于纯度阈值。
可能出现的峰纯度不够的问题,需考虑以下因素:
● 样品浓度过高,光谱图变形,从而导致峰纯度不可靠,可通过降低其进样浓度的方式对主峰纯度进行评估。
● 波长涵盖流动相或溶剂的截止波长,可通过调整全波长范围,对主峰纯度进行评估。
2降解试验----质量守恒
依照物料守恒原则,确保其可能存在的降解产物能被有效地分离且全部被检测到。
范围:(参见“分析方法学验证技巧与重点”)
(1)主成分在线性范围内,物料守恒应在98%-102%之间
(2)主成分不在线性范围内,物料守恒应在90%-110%之间
计算公式:

或

3降解试验----分离度要求
主成份和相邻杂质的分离度不得小于1.5,已知杂质与邻近峰的分离度不得小于1.2。
4破坏试验注意事项
有关物质和含量的方法若不是同一方法,两者均需进行强制降解试验。
● 破坏试验中,破坏出的已知杂质且样品中可检出,建议考虑该杂质的峰纯度。
● 对于制剂降解,一但确认为辅料降解,而非主成份降解,可在方法中注明,不予考虑其结构和高低。
● 若样品质量不守衡,则应进行深入研究,并对这种情况给出说明和解决问题的方案。挥发性杂质的潜在损失、非紫外吸收化合物的形成,交替检测技术,例如示差折光检测器与液质联用可以用来检测非紫外吸收的降解产物。
四、参考文献
[1] Available Guidance and Best Practices forConductingForced Degradation Studies
[2] Forced Degradation as an Integral Part of HPLCStability-IndicatingMethod Development
[3] ICHGuidelines,Q1A(R2).

来源:药事纵横


