您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-22 11:06
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.正大天晴马昔腾坦片首仿即将获批。正大天晴4类仿制药马昔腾坦片的上市申请已处于"在审批"状态,预计近期获批上市,有望成为该品种的首个仿制药。马昔腾坦(Macitentan)是全新一代内皮素受体拮抗剂,原研厂家为爱可泰隆(已被强生收购),商品名:Opsumit/傲朴舒,2013年10月获FDA批准上市,是首个获批用于肺动脉高压(PAH)的口服制剂,其2019年销售额达13.27亿美元。目前该原研产品已获批国内上市。
2.信达PD-1组合一线治疗sqNSCLC达III期主要终点。信达与礼来在ESMO2020年会上公布PD-1达伯舒®(信迪利单抗)联合健择®(吉西他滨)和铂类,与安慰剂联合健择®和铂类相比,一线治疗晚期鳞状非小细胞肺癌(sqNSCLC)的III期临床ORIENT-12的积极结果。与化疗组相比,PD-1组合显著延长了无进展生存期(PFS),两组由IRRC评估的中位PFS分别为5.5个月和4.9个月(HR=0.536, 95% CI: 0.422-0.681, P< 0.00001),研究者评估的中位PFS分别为6.7个月和4.9个月(HR=0.532, 95% CI: 0.419-0.674, P< 0.00001);期中分析的中位OS数据尚未成熟;安全性与既往研究一致。
3.基石药业舒格利单抗早期临床数据公布。基石药业在ESMO 2020大会上公布了PD-L1单抗CS1001(舒格利单抗)用于一线治疗的Ib临床试验中GC/GEJ(胃癌/胃食管结合部腺癌)和ESCC(食管鳞状细胞癌)两个队列的最新数据。截至2020年2月19日,在GC/GEJ队列29例患者中有18(62.1%)例患者达到部分缓解(PR),中位缓解持续时间(mDoR)为11.3 个月,中位无进展生存期(mPFS)8.3个月,中位总生存期(mOS)17.0个月;在ESCC队列37例患者中有25(67.6%)例达到了PR,ORR为68%, mPFS为9.0个月, mDoR和mOS仍未达到。
4.豪森首个生物类似药HS-20090启动临床。豪森2类生物药HS-20090登记启动一项I期临床,用于预防实体瘤骨转移患者和多发性骨髓瘤患者发生骨相关事件(SREs)、治疗成人或骨成熟青少年骨巨细胞瘤、治疗恶性肿瘤引发的双磷酸盐疗法难治性高钙血症。HS-20090是一款靶向RANKL的人lgG2单克隆抗体,属于地舒单抗的生物类似药。本次临床采用的对照药为安进的地舒单抗注射液(120 mg,Xgeva®),目标入组人数154人。
5.信立泰1类新药SAL007获批临床。信立泰「重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液」(SAL007)获国家药监局临床试验默示许可,拟用于治疗射血分数降低的慢性心力衰竭(NYHA II-III类)。SAL007是由信立泰旗下美国公司Salubris自主研发、具有全球知识产权的NRG-1(神经调节蛋白-1)融合抗体药物。该产品是信立泰第一个中美双报的创新生物药,已于2020年2月获FDA临床试验批准,目前正在美国开展人体临床试验。
6.石药注射用多西他赛(白蛋白结合型)在美获批临床。石药旗下附属公司石药中奇开发的注射用多西他赛(白蛋白结合型)获FDA批准在美国开展临床试验。该产品采用创新的人血白蛋白包裹技术,将多西他赛纳米粒输送至患者体内。在临床前研究中,该产品在多种动物模型中显示了安全性及对多种实体瘤增强的抗肿瘤疗效。相似的白蛋白包裹技术已成功应用于石药旗下紫杉醇产品。
国际药讯
1.百时美施贵宝Opdivo组合疗法治疗肾细胞癌达Ⅲ期临床终点。百时美施贵宝(BMS)与Exelixis公司在ESMO2020年会上公布了PD-1抑制剂Opdivo(nivolumab)与酪氨酸激酶抑制剂Cabometyx(cabozantinib)联用,一线治疗晚期肾细胞癌的关键性Ⅲ期临床CheckMate-9ER的积极结果。与活性对照组相比,这一组合疗法将患者死亡风险降低40%(HR=0.60,98.89 CI:0.40,0.89,p=0.001);两个治疗组患者的PFS分别为16.6个月和8.3个月(HR=0.51,95% CI:0.41,0.64,p<0.0001);两组ORR分别为56%和27%;所有疗效数据在各个亚群(包括PD-L1水平表达不同的亚群)中表现一致。目前,这一组合疗法已在欧盟和美国递交了监管申请。
2.诺华乳腺癌新药Piqray公布III期SOLAR-1研究OS结果。诺华在ESMO2020年会上公布其PI3K激酶抑制剂Piqray(alpelisib)与氟维司群联用,治疗携带PIK3CA突变、HR+/HER2-晚期乳腺癌(aBC)的III期临床SOLAR-1的总生存期(OS)数据。与氟维司群相比,联合疗法将患者的OS改善了8个月(中位OS:39.3个月vs31.4个月;单侧p≤0.0161;HR=0.86;95%CI:0.64-1.15;p=0.15),但不具统计学意义;肺或肝转移患者的OS改善达14个月以上(中位OS:37.2个月vs22.8个月;HR=0.68;95%CI:0.46-1.00);此外联合疗法将患者需要化疗的时间推迟了9个月;临床中未观察到新的安全信号。
3.Cend创新多肽疗法早期临床结果积极。Cend Therapeutics公司在ESMO2020年会上公布其创新多肽疗法CEND-1与吉西他滨和白蛋白紫杉醇联用,治疗转移性胰腺癌患者的Ⅰ期临床积极结果。试验结果表明,这一组合疗法在29例患者中达到59%的总缓解率,其中1例患者达到完全缓解,16例患者达到部分缓解,10例患者病情稳定,疾病控制率达到83%。与之相比,历史上支持白蛋白紫杉醇获批的临床试验值达到23%的总缓解率。
4.礼来与安进达成COVID-19抗体疗法合作。礼来与安进宣布,如果礼来的一种或多种COVID-19抗体疗法获得监管部门的批准,两家公司将合作扩大生产规模。此次合作中最有希望获得监管批准的是LY-CoV555,LY-CoV555是礼来与AbCellera联合开发的SARS-CoV-2棘突蛋白靶向中和抗体,已在Ⅱ期研究中减少门诊C0VID-19中度患者的住院和急诊就诊的时间。此外,礼来与君实联合开发的COVID-19抗体疗法LY-CoV016,也已进入了Ⅱ期试验。
5.诺华spartalizumab三联疗法黑色素瘤未达Ⅲ期PFS终点。诺华在ESMO2020年会上公布了spartalizumab(PDR001)+Tafinlar(dabrafenib)+Mekinist(trametinib)的组合疗法,用于治疗初治、不能切除(IIIC期)或转移性(IV期)BRAF V600突变阳性皮肤黑色素瘤的Ⅲ期COMBI-i研究结果。三联疗法在多个指标上的数值上优于Tafinlar和Mekinist的双药靶向疗法,三药组和双药组在一年、两年时PFS值以及平均PFS分别为58.4%vs50.1%、43.7%vs36.1%、16.2个月vs12.0个月,但不具统计学意义。
医药热点
1.深圳与香港拟合作建立第二家公立医院。9月18日,深圳市政府举行“合作举办香港中文大学(深圳)医院协议签署仪式”,未来深圳将与香港合作,建立第二家深港合作公立医院。香港中文大学(深圳)医院选址位于龙岗区坂田街道吉华路南侧,占地面积9.21万平方米,建筑面积58.64万平方米,规划床位3000张。目前医院建设工程已于2019年12月开工,预计于2026年12月31日前正式开业。
2.四川争创医养结合示范省。四川省发布《四川省创建全国医养结合示范省实施方案》,提出到2022年,全省30%以上的社区卫生服务中心和乡镇卫生院可开展医养结合服务,全省建成10个国家级智慧健康养老示范基地。《方案》将推动有条件的社区卫生服务中心设立以日间护理为重点的社区卫生服务站,鼓励乡镇卫生院设置康复、护理、安宁疗护病床和养老床位,城区新建社区卫生服务机构可内部建设社区医养结合服务设施,引导一批二级及以下医院转型为收治失能老年人的医养结合机构。
3.全球新冠确诊病例累计超3067万例。据美国约翰斯·霍普金斯大学统计数据显示,截至北京时间20日10时,全球确诊病例增至30673633例,累计死亡病例达955404例。欧洲多国疫情“复燃”,法国、英国19日单日新增确诊病例数均创新高。为遏制第二波疫情传播,英国政府拟修订法律,将可能感染新冠病毒需自我隔离制定成为一项法律条款,违反者将面临最高1万英镑的罚款。
股市资讯
【桂林三金】公司控股孙公司宝船生物医药科技(上海)有限公司获国家药监局核准签发的药物临床试验批准通知书,拟于近期条件具备后于中国境内开展该项评价全人源抗 PD -L1 抗体注射液(产品代号:LDP)联合重组抗 EGFR 人鼠嵌合单克隆抗体注射液(产品代号:CDP1)在晚期恶性肿瘤患者中的探索性临床研究实验。
【南卫股份】公司用于事故现场、战场救治四肢出血时进行止血处理的产品旋压式止血带获得二类医疗器械注册证。
【新华制药】公司全资子公司新华制药(高密)有限公司的盐酸地尔硫䓬片(30 mg)产品通过仿制药质量和疗效一致性评价,高密公司成为国内盐酸地尔硫䓬片(30 mg)首家通过仿制药一致性评价的企业。
审评动向
1. CDE最新受理情况(09月21日)
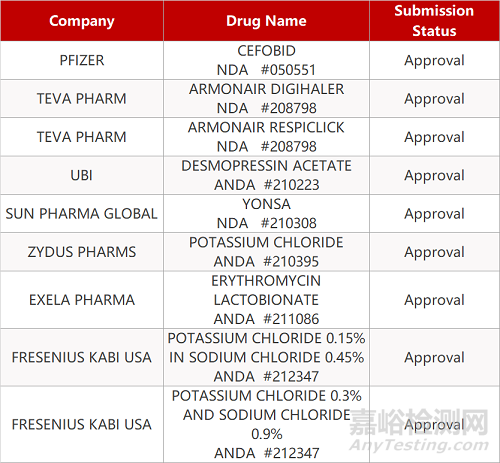
2. FDA最新获批情况(北美09月18日)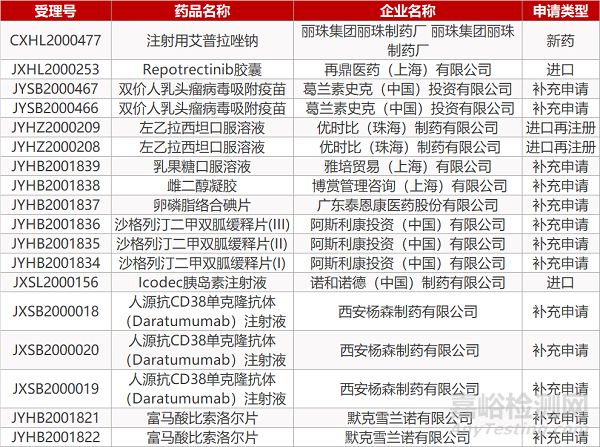
- The End -

来源:药研发


