您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-02-21 09:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:14条资讯,阅读时长约:3分钟 」
罗氏Tecentriq补充申请获FDA优先审评资格。罗氏宣布,FDA已受理其重磅PD-L1抑制剂Tecentriq(atezolizumab)的补充生物制品许可申请,用于一线单药治疗PD-L1高表达且无EGFR或ALK基因突变的晚期非鳞状和鳞状非小细胞肺癌(NSCLC)患者。FDA同时授予其优先审评资格,将在6月19日之前做出批准决定。一项Ⅲ期临床IMpower110结果显示,在PD-L1高表达患者中,与化疗相比,Tecentriq单药治疗使中位总生存期延长7.1个月(20.2个月比13.1个月;HR=0.595,95% CI:0.398-0.890;p=0.0106)。
1.恒瑞氟唑帕利治疗卵巢癌III期临床启动。恒瑞医药登记启动一项氟唑帕利或氟唑帕利联合甲磺酸阿帕替尼对比安慰剂用于晚期卵巢癌一线含铂化疗后维持治疗的III期临床研究。该研究计划入组680例晚期卵巢癌患者。研究分为两个阶段,第一阶段评估氟唑帕利联合阿帕替尼治疗铂敏感的复发性卵巢癌患者的安全性。第二阶段评估氟唑帕利单药对比安慰剂用于伴有BRCA1/2突变的晚期卵巢癌一线含铂化疗后的维持治疗的有效性;评估氟唑帕利联合甲磺酸阿帕替尼对比安慰剂用于晚期卵巢癌一线含铂化疗后的维持治疗的有效性。氟唑帕利是一种PARP抑制剂。
2.丽珠医药IL-17A/F单抗临床申请获批。丽珠集团旗下丽珠单抗与鑫康合生物联合申报的“重组抗人IL-17A/F人源化单克隆抗体注射液”临床申请获国家药监局批准。拟开发适应症为中重度斑块型银屑病。根据公开信息,在中国目前针对IL-17A靶点已有两款进口产品于2019年获批上市,以及5款中国国内企业的在研药物已获批临床,均处于早起临床开发阶段。而针对IL-17A/F靶点,目前全球尚未有产品上市;在中国,国内企业尚无同靶点药物申报临床。
3.万孚生物两项产品进入应急审批通道。万孚生物申报的适用于疫情现场的新冠病毒抗原快速检测试剂、基于荧光微球/胶体金免疫层析技术新冠病毒抗体快速检测试剂,两项目的产品已获国务院应对新冠肺炎疫情联防联控机制(科研攻关组)办公室推荐进入应急审批通道。据悉,为应对新冠病毒疫情防控的需求,万孚生物积极开展 2019-nCoV新型冠状病毒抗原、抗体检测产品的研发,系列产品包括基于胶体金免疫层析法的2019-nCoV新型冠状病毒抗原检测试剂、抗体检测试剂,以及基于荧光PCR平台的2019-nCoV新型冠状病毒核酸检测试剂盒。
4.精华制药终止两项全人源单抗产品合作研发。2月19日晚间,精华制药发布公告称,于2015年10月29日与美国 Kadmon Corporation, LLC 公司签署《合作与授权协议》,就VEGFR-2全人源单抗和PDL-1全人源单抗产品开发进行合作。精华制药称,截至目前,上述两项产品仍处于临床前研发阶段,研究结果及进度不符合预期。考虑到市场竞争实际情况,预计项目受益不明显且面临较大风险,经与美国kadmon公司协商,决定终止项目的研发工作。
5.瑞康医药独立董事长权玉华辞职。瑞康医药发布公告称,董事会于近日收到公司独立董事权玉华女士的书面辞职报告,权玉华女士因个人原因申请辞去公司独立董事及相关专门委员会职务,辞职后其本人将不再担任公司任何职务。根据《关于在上市公司建立独立董事制度的指导意见》、《公司章程》的有关规定,权玉华女士的辞职申请将自公司股东大会选举产生新任独立董事后生效。
1.辉瑞ATTR-CM治疗药物Vyndaqel获欧盟批准。辉瑞口服胶囊Vyndaqel(tafamidis,61mg)获欧盟委员会批准,每日一次用于治疗野生型或遗传型转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)成人患者。Vyndaqel是欧盟批准治疗ATTR-CM的首个药物,唯一一个被证明可降低野生型或遗传型ATTR-CM患者死亡率和心血管相关住院率的药物。在欧盟,Vyndaqel也是首个可同时治疗ATTR-CM和1期症状性转甲状腺素蛋白淀粉样变性多发性神经病的药物。
2.Incyte外用JAK抑制剂达到Ⅲ期临床终点。Incyte公司JAK抑制剂ruxolitinib乳膏(外用)在治疗轻中度青少年和成人特应性皮炎患者的第二项Ⅲ期临床TRuE-AD1中达到主要研究终点。治疗8周后,与对照组相比,使50%(剂量为0.75%)和53.8%(剂量为1.5%)患者的研究者总体评估总分(IGA)较基线时达到2分以上的显著改善,而安慰剂组中达到这一标准的患者只有15.1%。此前,ruxolitinib在治疗特应性皮炎的第一项Ⅲ期临床TRuE-AD2中也达主要终点。另外,在两项试验中,接受两种剂量ruxolitinib治疗的患者中均观察到由瘙痒数字评定量表(NRS4)测量的止痒效果。
3.Immutep公司LAG-3疗法显著提高Keytruda缓解率。Immutep公司可溶性LAG-3融合蛋白eftilagimod alpha(efti,IMP321)与PD-1抑制剂Keytruda联用,在治疗不同类型的非小细胞肺癌(NSCLC)以及头颈部鳞细胞癌的Ⅱ期临床TACTI-002中获积极中期结果。在从未接受过PD-1/PD-L1抑制剂治疗的NSCLC患者(不论PD-L1表达水平)中,该组合疗法达到47%的总缓解率。而通常情况下,如果不筛选PD-L1表达水平高的患者,Keytruda单药疗法治疗NSCLC患者的缓解率只有20%。LAG-3疗法显著提高了Keytruda缓解率。同时,这一组合疗法二线治疗头颈部鳞细胞癌患者时也达到33%的ORR。
4.Five Prime新药联合Opdivo胰腺癌Ⅱ期临床失败。Five Prime Therapeutics宣布,与百时美施贵宝合作开展的Cabiralizumab(卡比拉单抗)与Opdivo(nivolumab,纳武单抗)联合治疗晚期胰腺癌Ⅱ期临床(NCT03336216)未达到其主要终点。该研究入组了约160例局部化疗或一线化疗后进展的局部晚期或转移性胰腺癌患者。由BMS主导的试验的具体分析数据并未公布,但其指出在Ⅱ期试验中未观察到联合疗法显示出新的安全问题。
5.Imara公司拟IPO募资推进PDE9抑制剂。Imara公司宣布拟IPO募资8600万美元,进一步推进其治疗镰状细胞贫血症(SCD)的首款候选药物IMR-687的临床开发。IMR-687是一种磷酸二酯酶9(PDE9)抑制剂,目前正在Ⅱ期临床中验证其治疗SCD患者的安全性与疗效。IMR-687治疗SCD患者的Ⅱa期临床研究初步数据预计将在今年第四季度获得。Imara公司还计划将IMR-687用于β地中海贫血症患者的治疗中,并计划在今年上半年启动其治疗SCD和β地中海贫血症患者的两项Ⅱb期研究。
1.全球首份新冠肺炎病理报告发布。中国人民解放军总医院第五医学中心王福生院士团队在医学期刊《The Lancet Respiratory Medicine》发布了一例COVID-19患者的遗体病理报告。研究人员从患者的肺、肝和心脏组织中提取样本。胸部X光片显示肺炎发展迅速,其中右肺可见肺细胞脱落和透明膜形成,左肺组织显示肺水肿伴透明膜形成,表明患者患有急性呼吸窘迫综合征(ARDS),这与SARS和MERS患者的病理特征非常相似。此外,肝组织中显示中度微血管脂肪变性和轻度小叶活动,心脏组织中没有发现明显的组织学变化。对外周血液采用流式细胞术分析发现,患者免疫系统严重受损。
2.广东已有纯中医治疗患者痊愈出院。广东省政府新闻办举行疫情防控新闻发布会,重点介绍中医药在广东省疫情防控中的运用情况。据统计,截至2月18日24时,在广东省确诊病例1331例中,中医药参与治疗的有1245例,参与率达93.54%;中医药参与治疗确诊病例中,单纯使用中药汤剂的913例、单纯使用中成药的177例,中药汤剂与中成药配合使用的155例。中医药参与治疗确诊病例中,治愈出院448例,平均住院日14.5天,症状改善660例,有效率达89%。在广州市第八人民医院,初步统计有30例新冠肺炎患者为纯中医治疗,且已有患者治愈出院。
3.GSK将关闭美国非处方药工厂,裁员260人。葛兰素史克(GSK)日前宣布,将于2021年关闭位于美国宾夕法尼亚州卡莱尔的非处方药(OTC)制造工厂。卡莱尔工厂目前主要由GSK运营生产Emergen-C,这是一种混合维生素C补充剂的粉末状饮料。GSK表示,到2021年底,Emergen-C的生产将全部移至波多黎各瓜山市的工厂,而卡莱尔工厂将裁员260人并停工。2020年,GSK还启动为期两年的拆分计划,将其拥有的消费者医疗保健业务份额剥离成为独立的公司,而“新”GSK作为一家生物制药公司,专注于免疫系统、遗传学和新技术有关的科学研究,以改善运营绩效。
【海思科】全资子公司四川海思科制药有限公司的环泊酚乳状注射液拟纳入优先审评,环泊酚乳状注射液拟用于手术全麻诱导、内镜诊疗的镇静/麻醉、ICU 镇静等适应症。
【普门科技】2019年度公司实现营业收入4.23亿元(+30.68%),实现归母净利润1亿元(+23.93%)。
【昭衍新药】截止本公告日,董事顾晓磊先生及其一致行动人顾美芳减持完毕,其中顾晓磊减持40万股。
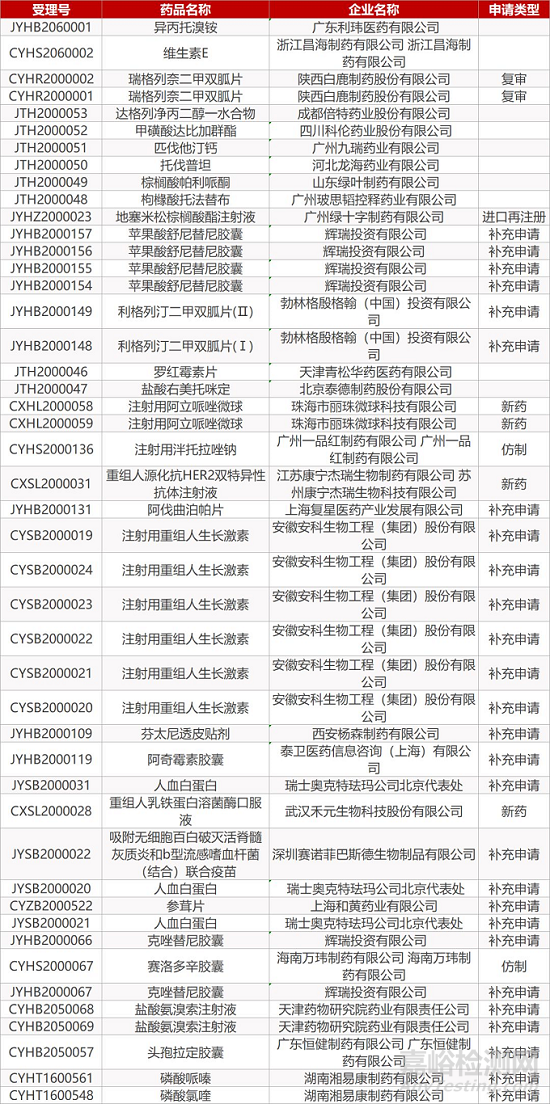
1. CDE最新受理情况(2月20日)
- The End -

来源:未知


