您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-02-17 08:37
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
中国生物治疗性新冠特免血浆投入临床。2月13日晚,中国生物宣布,本次新冠肺炎康复者血浆中已检测出高效价病毒中和抗体,实验证明,能够有效杀死新冠病毒。该公司联合武汉市江夏区第一人民医院采用经过病毒灭活处理的康复者特异血浆临床治疗11例危重病人,临床反映,患者接受治疗12至24小时后,实验室检测主要炎症指标明显下降,淋巴细胞比例上升,血氧饱和度、病毒载量等重点指标全面向好,临床体征和症状明显好转。
1.石四药多索茶碱注射液首家通过一致性评价。石四药4类仿制药多索茶碱注射液(10ml:0.1g)获国家药监局核发的药品生产注册批件,成为该品种首家通过一致性评价的产品。多索茶碱是甲基黄嘌呤的衍生物,主要用于治疗支气管哮喘、慢性喘息性支气管炎及其他支气管痉挛引起的呼吸困难。米内网数据显示,2018年中国公立医疗机构终端多索茶碱销售额为31.5亿元,在呼吸系统化药通用名药品TOP10中排位第三。
2.新华制药头孢氨苄胶囊通过一致性评价。新华制药头孢氨苄胶囊(0.25g和0.125g)获国家药监局核发的《药品补充申请批件》,该产品通过一致性评价。头孢氨苄属于第一代口服头孢菌素类抗生素药物,最早由礼来合成,主要用于治疗敏感菌所致的急性扁桃体炎、咽峡炎、鼻窦炎、支气管炎、肺炎等呼吸道感染、中耳炎、尿路感染及皮肤软组织感染等。2018年度,头孢氨苄的中国公立医疗机构终端销售额达2.65亿元。目前,头孢氨苄胶囊过评企业已达8家。
3.渤健富马酸二甲酯国内申报上市。2月15日,渤健提交的多发性硬化症新药富马酸二甲酯肠溶胶囊(商品名:Tecfidera)的上市申请获CDE承办受理。Tecfidera是继芬戈莫德、特立氟胺之后全球上市的第3款口服多发性硬化症药物,也是渤健的头牌产品,2019年全球销售额达到44.33亿美元,占到该公司总收入的31%。目前国内这个品种的在研厂家共有11家(17个受理号)。其中,人福药业登记开展了BE临床试验。
4.丽珠旗下3种新冠病毒抗体检测试剂研发进展。丽珠集团宣布,其控股附属公司丽珠试剂与中国科学院武汉病毒研究所联合研制的新型冠状病毒IgM抗体检测试剂(胶体金法)、新型冠状病毒IgG抗体检测试剂(胶体金法)已通过体外诊断试剂应急审批答辩,并于2月11日正式进入快速审批通道。同时,由中国食品药品检定研究院、中国科学院武汉病毒研究所和丽珠试剂共同申报的科技部应急项目,新型冠状病毒IgM抗体检测试剂盒(酶联免疫法)也于2月11日正式进入国家应急审批通道。
5.歌礼ASC09复方片治疗新冠临床研究获批。2月13日,歌礼制药宣布,由重庆医科大学附属第二医院胡鹏教授团队发起的ASC09复方片联合α-干扰素雾化治疗新型冠状病毒肺炎临床研究获重庆医科大学附属第二医院伦理委员会批准。截止日前,ASC09复方片已获得武汉同济医院、浙江大学医学院附属第一医院和重庆医科大学附属第二医院等批准开展治疗新型冠状病毒肺炎临床研究。
6.阿斯利康2019年财报公布。阿斯利康公布2019年财报,报告显示,总收入243.84亿美元,同比增长10%;中国区收入48.80亿美元,同比增长35%,占到阿斯利康全球总收入的20.7%。从整体产品线上来看,Nexium、Crestor、Iressa这些过专利期经典老产品对阿斯利康业绩的影响已越来越小。2019年阿斯利康主要药品销售额:三代EGFR抑制剂Tagrisso(奥希替尼)为31.89亿(+71.5%);PD-L1单抗Imfinzi(度伐利尤单抗)为14.69亿(+132.1%);PARP抑制剂Lynparza(奥拉帕利)为11.98亿(+85.2%)等。
1.诺华计划关闭一英国工厂。诺华首席执行官Vas Narasimhan近日报告投资者,正朝着将其制造业务整合为一个更加专注于高端技术的目标迈进。最新的进展是,诺华计划从4月起,关闭其英国Grimsby工厂,这是诺华三个主要制造工厂之一。据悉,该工厂占地220英亩,其中一些财产可以单独出售。诺华表示,除非可以找到买家,否则约会有400名工人失业。
2.工信部发布疫情防控重点保障物资(医疗应急)清单。2月14日,工信部正式发布疫情防控重点保障物资(医疗应急)清单。在药品项目中,一般治疗及重症、危重症病例治疗药品包括α-干扰素、洛匹那韦利托那韦片,抗菌药物、甲泼尼龙、糖皮质激素等;中医治疗药品包括藿香正气胶囊(丸、水、口服液)、金花清感颗粒、连花清瘟胶囊(颗粒)、疏风解毒胶囊(颗粒)、防风通圣丸(颗粒)、喜炎平注射剂,参附注射液、生脉注射液、苏合香丸、安宫牛黄丸等。
3.全国报告1716名医务人员感染。2月14日,国务院应对新冠病毒感染肺炎疫情联防联控机制举行新闻发布会。截至2月11日24时,全国共报告医务人员确诊病例1716例,占全国确诊病例的3.8%,其中6人不幸辞世。目前,国家已发布相关措施文件,要求各地根据疫情防控实际情况合理配置医务人员,既要满足医疗服务需求,又要保障医务人员的休息时间;各级财政用于医疗设备和防护物资购置、支持改善医疗卫生机构设施条件的支出已达到259.4亿元;并对感染新冠肺炎的医务人员给予工伤保险保障,开通工伤认定绿色通道。
【三诺生物】报告期内,公司实现营业收入17.76亿元(+14.55%),归母净利润2.55亿元(-17.82%)
【恒瑞医药】(1)公司及子公司上海恒瑞医药有限公司近日收到国家药品监督管理局核准签发的《临床试验通知书》,并将于近期开展临床试验,试验药品为氟唑帕利胶囊和甲磺酸阿帕替尼片,氟唑帕利可特异性杀伤BRCA突变的肿瘤细胞,其国外同类产品2018全球销售额约为6.72亿美元,甲磺酸阿帕替尼用于治疗既往至少接受过2种系统化疗后进展或复发的晚期胃腺癌或胃-食管结合部腺癌患者,2018年甲磺酸阿帕替尼销售额约为17亿元人民币。
【济川药业】(1)公司监事会提名孙荣、周新春为公司第九届监事会非职工代表监事候选人。(2)公司董事会提名委员会审核同意,曹龙祥、曹飞、黄曲荣、刘俊为公司第九届董事会董事候选人,姚宏先生、卢超军先生、朱四一先生为公司第九届董事会独立董事候选人。
1. CDE最新受理情况(2月16日)
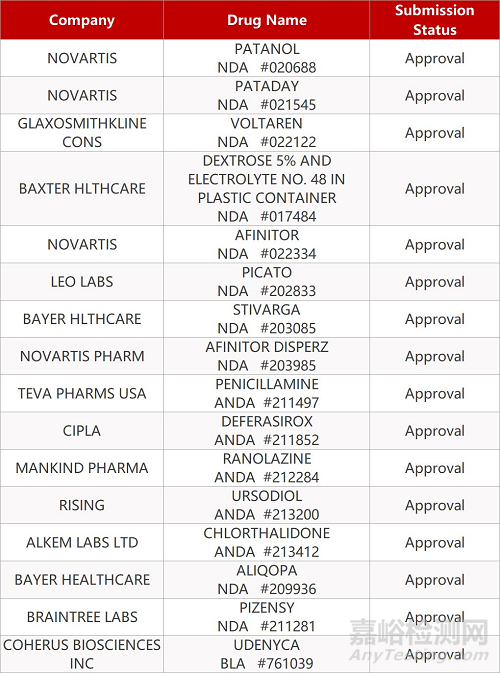
2. FDA最新获批情况(北美2月15日)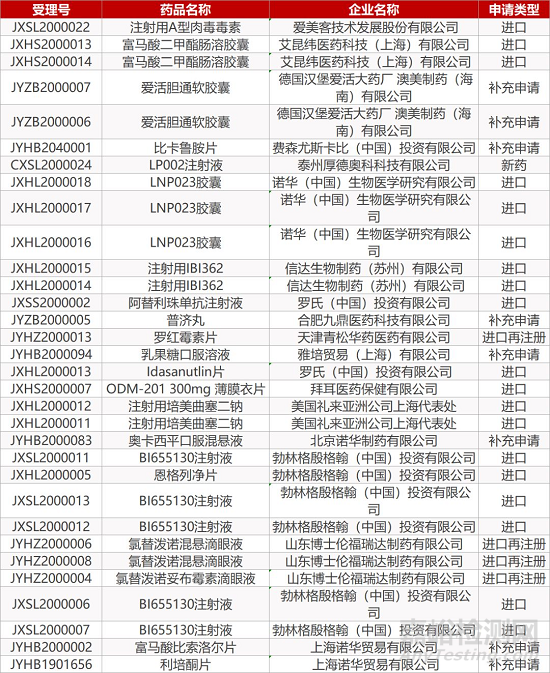

来源:药研发


